
 )4种有机物分别在一定条件下与H2充分反应.
)4种有机物分别在一定条件下与H2充分反应.分析 ①若烃与H2完全加成反应时的物质的量之比为1:3,给出的物质中只有含有苯环、不含有其它不饱和键符合;
②若烃与H2完全加成反应时的物质的量之比为1:2,可以含有2个碳碳双键或1个碳碳三键;
③苯乙烯中苯环、碳碳双键均与氢气发生加成反应.
解答 解:乙烯、乙炔、甲苯、苯乙烯( )4种有机物分别在一定条件下与H2充分反应,由氢气的物质的量之比分别为1:1、1:2、1:3、1:4.
)4种有机物分别在一定条件下与H2充分反应,由氢气的物质的量之比分别为1:1、1:2、1:3、1:4.
①若烃与H2完全加成反应时的物质的量之比为1:3,则甲苯符合,故答案为:甲苯;
②若烃与H2完全加成反应时的物质的量之比为1:2,则乙炔符合,故答案为:乙炔;
③苯乙烯中苯环、碳碳双键均与氢气发生加成反应,苯乙烯与H2完全加成的物质的量之比为1:3,故答案为:1:4.
点评 本题考查加成反应有关计算、有机物分子式确定,比较基础,注意对基础知识的理解掌握.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 提出原子学说,为近代化学的发展奠定了坚实基础的科学家是拉瓦锡 | |
| B. | 化学的特征就是认识分子和制造分子 | |
| C. | 在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和 | |
| D. | 英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是含有一种相同元素的五种物质,一定条件下可发生如图所示的转化.其中A是单质,B是常见的10电子体分子,E是含氧酸,回答问题.
A、B、C、D、E是含有一种相同元素的五种物质,一定条件下可发生如图所示的转化.其中A是单质,B是常见的10电子体分子,E是含氧酸,回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 硫化钠的水解:S2-+H2O═HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫铝是纯净物 | |
| B. | 泡沫铝是一种合金 | |
| C. | 泡沫铝是一种优质的建筑材料和轻质材料 | |
| D. | 泡沫铝可用于飞机制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
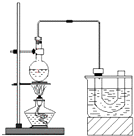 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com