
【题目】将![]() 转变为
转变为![]() 的方法为
的方法为
A.溶液加热,通入足量的HCl
B.与稀H2SO4 共热后,加入足量的NaHCO3 溶液
C.与足量的NaOH 溶液共热后,再用稀H2SO4 酸化
D.与稀 H2SO4 共热后,加入足量的NaOH 溶液
科目:高中化学 来源: 题型:
【题目】法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是

A.法匹拉韦的分子式为C5H4N3O2F
B.法匹拉韦最多能与4 mol H2发生加成反应
C.法匹拉韦在一定条件下能与NaOH溶液发生反应
D.法匹拉韦能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是
A. 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
B. 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
D. 纤维素、聚乙烯、光导纤维都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在一定量0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列说法不正确的是( )

A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
B. Ksp[Al(OH3)]=10-32
C. c~d段,溶液中离子浓度的关系为:c(Na+)+ c(H+)+ 3c(Al3+)= c(OH-)+c(AlO2-)
D. d点时,溶液中离子浓度的大小关系为:c(Na+)>c(AlO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH→CH3COO+CH3CH2O+H2O
B. 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
D. 乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O↓+3H2O
CH3COO+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2一二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3一氯丙烯(CH2=CHCH2Cl),反应原理为:
i .CH2 =CHCH3(g) +C12(g)CH2ClCHClCH3(g) △H1=-134kJmol-1
ii . CH2 =CHCH3(g) +C12(g)CH2= CHCH2Cl(g) +HCl(g) △H2 =-102kJmol-1
请回答下列问题:
(1)已知:CH2 =CHCH2Cl (g) + HCl ( g)CH2ClCHClCH3(g)的正反应的活化能Ea(正)为132 kJmol-1,则逆反应的活化能Ea(逆)为__________ kJmol-1 。
(2)某研究小组向密闭容器中充入一定量的C12(g)和CH2 =CHCH3 ( g),分别在 A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图1所示。
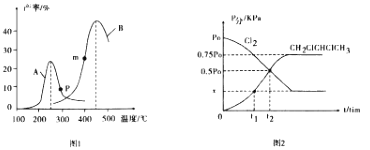
①下列说法正确的是______(填代号)。
a .使用催化剂A、B的最佳温度:A <B
b .p、m点分别是对应温度下CH2ClCHClCH3的平衡产率
c. 使用催化剂降低了反应的活化能和焓变
d. 温度不变,增大压强可使CH2ClCHClCH3的产率提高
②在250℃以后,A曲线中产率下降的原因可能是________(写出两条)。
(3)T℃时使用选择性更高的催化剂,在恒容密闭容器内充入等物质的量的C12 ( g) 和CH2=CHCH3 (g)进行反应i,测得容器各组分的分压强(p分=p总×体积分数)随时间的变化关系如图2所示,回答下列问题:
①若用单位时间内气体分压的变化来表示反应速率,即υ= ![]() ,则t1~t2时间段内平均反应速率υ(CH2=CHCH3)= _______ kPamin-1(用相关字母表示);平衡时CH2ClCHClCH3的体积分数________。
,则t1~t2时间段内平均反应速率υ(CH2=CHCH3)= _______ kPamin-1(用相关字母表示);平衡时CH2ClCHClCH3的体积分数________。
②反应的平衡常数KP=_____________(用平衡分压代替平衡浓度,相关字母表示结果)。
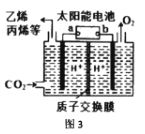
(4)如图3是在酸性电解质溶液中,用惰性电极将CO2转化为低碳烯烃的电化学装置,回答下列问题:
①太阳能电池的负极是 __________(填“a”或“b”)。
②生成丙烯的电极反应式是____________。
③相同时间内,相同条件下,消耗的CO2与生成的O2 的体积之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇![]() )电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
)电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
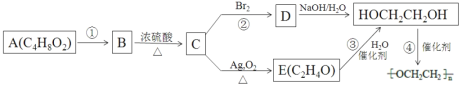
(1)E 物质的名称是_____。
(2)D 的键线式是_____。
(3)反应④的化学方程式是_____。
(4)下列说法正确的是_____。
a.A 在酸性或碱性条件下都可以反应得到B,反应②中的 Br2 可以是溴水或溴的 CCl4 溶液
b.工业上获得C 的的主要方法是催化裂化
c.可以用饱和碳酸钠溶液除去 B 中混有的少量A
d.反应①的反应类型为水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示,下列叙述错误的是
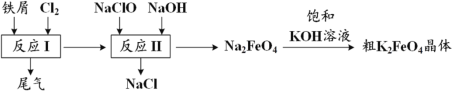
A.用 K2FeO4 作水处理剂时,既能杀菌消毒又能净化水
B.反应 I 中尾气可用 FeCl2 溶液吸收再利用
C.反应 II 中氧化剂与还原剂的物质的量之比为 2:3
D.该条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H =" -1160" kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com