
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:填空题
 如图是A分子的球棍模型和B分子的比例模型,回答下列问
如图是A分子的球棍模型和B分子的比例模型,回答下列问查看答案和解析>>
科目:高中化学 来源: 题型:解答题
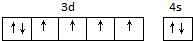 .
. ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
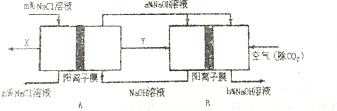
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
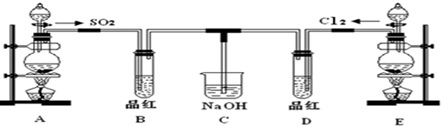
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com