
分析 (1)浓硫酸增重10.8g为反应生成的水的质量,通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,固体质量减轻了3.2g,结合固体质量变化利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了17.6g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算1mol有机物中含有C、H、O的物质的量,进而求得化学式;
(2)结合分子式、有机物与钠反应消耗钠的量,判断分子中官能团,据此书写结构简式;
(3)HOCH2CH2OH与与金属钠反应生成NaOCH2CH2ONa和氢气,据此写出反应的化学方程式.
解答 解:(1)有机物燃烧生成水10.8g,物质的量为:$\frac{10.8g}{18g/mol}$=0.6mol,
令有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 固体减少△m
28g 16g
x 3.2g
所以x=$\frac{28g×3.2g}{16g}$=5.6g,CO的物质的量为:$\frac{5.6g}{28g/mol}$=0.2mol,
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g,
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,其物质的量为:$\frac{8.8g}{44g/mol}$=0.2mol,
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为:$\frac{0.2mol+0.2mol}{0.2}$=2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为:$\frac{0.6mol×2}{0.2}$=6mol
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为:$\frac{0.6mol+0.2mol+0.2mol×2-0.4mol×2}{0.2}$=2mol,
所以有机物的分子式为:C2H6O2,
答:有机物的分子式为C2H6O2;
(2)0.2mol该有机物恰好与9.2 g金属钠完全反应,9.2g钠的物质的量为为:$\frac{9.2g}{23g/mol}$=0.4mol,说明1mol该有机物完全反应消耗了2mol钠,
则该有机物分子中含有羟2个-OH,其结构简式为:HOCH2CH2OH,
答:该有机物的结构简式为HOCH2CH2OH;
(2)HOCH2CH2OH与与金属钠反应生成NaOCH2CH2ONa和氢气,断开羟基上的氢氧键,反应方程式为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑,
答:该反应的化学方程式为HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑.
点评 本题考查了有机物分子式、结构简式的确定及有机反应方程式书写,题目难度中等,注意掌握常见有机物结构与性质,明确质量守恒定律在确定有机物分子式中的应用方法.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaClO溶液通入少量SO2气体:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 将过量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氢钙溶液滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
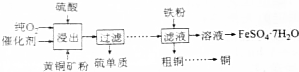
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是分解反应 | B. | 该反应的熵增效应大于焓变效应 | ||
| C. | 该反应是熵减反应 | D. | 该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
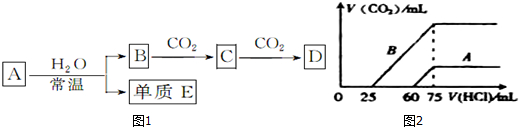
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧,产物是Na2O | B. | 钠是银白色金属,硬度大,熔点高 | ||
| C. | 钠在空气中燃烧,发出黄色火焰 | D. | 钠与水反应生成O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com