
【题目】常温时,用![]() 滴定
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
【答案】D
【解析】
根据滴定曲线(特殊点)的含义,分析电解质强弱、电离与水解的主次关系,并运用物料守恒关系解答。
A项:滴入![]() 溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HX
溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HX![]() H++X-,A项错误;
H++X-,A项错误;
B项:点a溶液中生成1.5mmolNaX、剩余1.0mmolHX。因溶液呈酸性,HX电离程度大于X-的水解程度,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),B项错误;
C项:当![]() 与
与![]() 恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误;
恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误;
D项:据物料守恒,曲线上任何一点都有n(X-)+n(HX)=25mL×0.10mol·L-1,点c溶液总体积约50mL,则![]() ,D项正确。
,D项正确。
本题选D。


科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
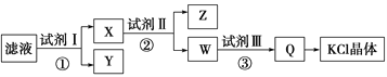
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为1L的密闭容器中,0.3molX和0.2molY进行反应:2X(g)+Y(s) ![]() Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
A. 若增加Y的物质的量,则V正大于V逆平衡正向移动
B. 以Y浓度变化表示的反应速率为0.01mol·L-1·s-1
C. 该反应的平衡常数为10
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标况下),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合气体,且体积比为1:1,则V可能为( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干离子组成,取该溶液进行如下实验:

(1)白色沉淀甲是___;
(2)试写出实验过程中生成气体A、B的离子方程式___;
(3)通过上述实验,可确定X溶液中一定存在的阴离子是___;尚未确定是否存在的离子是___;
(4)若要检验溶液中是否含有CO32-离子,其方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组在探究新制饱和氯水成分的实验中,根据实验现象推测的有关结论中错误的是
A.向氯水中滴入紫色石蕊溶液看到其先变红后褪色,推测氯水中含有Cl2分子
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,推测氯水中可能含有Cl-
C.向氯水中加入碳酸钠粉末,有气泡产生,推测氯水中含有H+
D.氯水放置一周后pH将变大,说明氯水中含有ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阳离子![]() 共有m个电子,则中子数N=_______。
共有m个电子,则中子数N=_______。
(2)某金属氯化物MCl240.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是________。
(3)KClO2属于钾盐,其中氯元素的化合价为_______;KClO2在水溶液中完全电离,则其电离方程式为:_______。
(4)写出分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体的方法_,写出从碘水中提取碘单质的方法_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450ml.提供的试剂是:NaOH固体、98%的浓硫酸(密度为1.84g/cm3)和蒸馏水.

(1)请你观察图示判断其中不正确的操作有_________(填序号).
(2)应用托盘天平称量NaOH_______g,应用量筒量取浓硫酸________mL.
(3)浓硫酸溶于水的正确操作方法是_________________________
(4)在配制H2SO4溶液实验中,下列操作引起结果偏高的有___________
A.该学生在量取浓硫酸时,俯视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
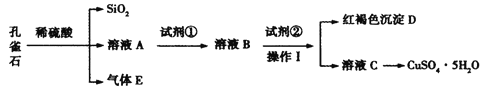
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
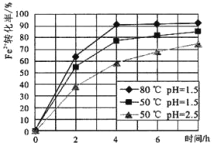
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com