
【题目】物质发生化学反应时:①电子总数;②质子总数;③物质的结构;④分子总数;⑤物质所具有的总能量;⑥物质的总质量。反应前后肯定发生变化的是( )
A.①② B.⑤⑥ C.④⑥ D.③⑤
科目:高中化学 来源: 题型:
【题目】硅被誉为无机非金属材料的主角。有科学家提出硅是“21世纪的能源”“未来的石油”。下列有关说法正确的是( )
A.硅的含量居第二位,在地球上有丰富的单质硅资源,如石英、水晶的主要成分都是SiO2
B.单质硅是一种良好的半导体材料,可用于制造太阳能电池
C.存放NaOH溶液的试剂瓶应用玻璃塞
D.60gSiO2含有1NA 个SiO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
A. 224mL B. 336mL C. 448mL D. 672mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能的是 ( )
A.m︰n=2︰1 B.m=2x+2 C.x︰m︰n=1︰2︰1 D.m>2x+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2H2S+O2=2S↓+2H2O,Na2S+I2=2NaI+S↓
4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,下列物质的氧化性强弱判断正确的是
A.H2O>NaI>H2S B.H2S>NaI>H2O C.S>I2>O2 D.O2>I2>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将淀粉与KCl的混合液装在半透膜中,浸泡在装有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜有破损的是
A.加入碘水不变色 B.加入AgNO3 溶液产生白色沉淀
C.加入AgNO3 溶液不产生白色沉淀 D.加入碘水变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
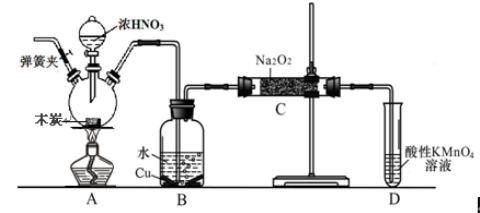
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2) B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
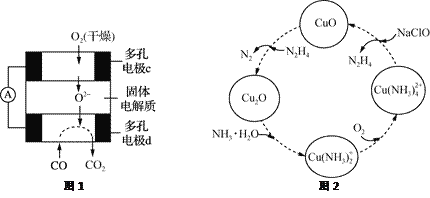
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
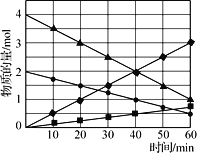
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com