
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
试剂 用量 (mL) | 0.20mol•L-1(NH4)2 S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20mol•L-1KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010mol•L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20mol•L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20mol•L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
分析 (1)根据在此对比实验中各组实验的溶液体积均为50mL来计算;
(2)为了使反应充分进行,应不断搅拌来加快反应速率;
(3)根据第①组实验的反应时间为32s可知求算出v(S2O32-),根据在化学方程式中,反应速率之比等于计量数之比来计算;
(4)将②③④⑤的反应时间与①的反应时间做对比即可得出结论.
解答 解:(1)在此对比实验中各组实验的溶液体积应均为50mL,故a=8.0mL,b=5mL,c=15mL,故答案为:8.0;5;15;
(2)为了使S2O32-和I2的反应充分进行,应不断搅拌来加快反应速率,故答案为:搅拌;
(3)根据第①组实验变蓝的时间为32s,即S2O32-反应完全的时间为32s,故v(S2O32-)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{8×1{0}^{-5}mol}{0.05L}}{32s}$=5×10-5,将反应(1)+(2)可得:S2O82-+2S2O32-=2SO42-+S4O62-,根据在化学方程式中,反应速率之比等于计量数之比,故V(S2O82-)=$\frac{1}{2}$v(S2O32-)=2.5×10-5,故答案为:2.5×10-5;
(4)实验②③④⑤与①相比,溶液体积相同,Na2S2O3溶液浓度相同,淀粉溶液浓度相同,K+浓度相同,NH4+浓度相同,其中②③中S2O82-浓度比①小,则反应时间比①长,说明反应速率变慢;④⑤中I-浓度比①中小,反应时间比①长,说明反应速率变慢.故可以得出结论:S2O82-或I-的浓度越小,反应速率越慢.
故答案为:S2O82-或I-的浓度越小,反应速率越慢.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,注意掌握化学反应速率的影响因素,明确在做对比实验时只能改变一个条件,其它条件必须相同,否则无法得出正确结论,试题培养了学生的分析、理解能力及化学实验能力.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Fe、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Ag、负极为Fe,电解质溶液为CuSO4溶液 | |
| C. | 正极为Fe、负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为C、负极为Fe,电解质溶液为Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-3mol/L | B. | 10-7 mol/L | C. | 10-11 mol/L | D. | 10-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
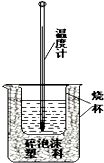 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质强 | |
| B. | 冰醋酸是弱电解质,但液态时不能导电 | |
| C. | 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
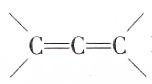 不稳定).
不稳定).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com