
| A. |  | B. | 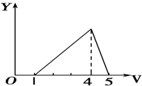 | C. | 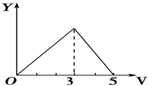 | D. | 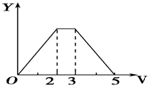 |
分析 假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol,开始滴加同时发生反应为:Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol;
然后发生反应:NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变;
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH;
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,物质的量之比等于体积之比,据此结合图象进行判断.
解答 解:假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol,
开始滴加NaOH发生反应为:Al3++3OH-=Al(OH)3↓,沉淀逐渐增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,沉淀量达最大值;
然后发生反应为:NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变;
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1,
A.由分析可知,开始滴加NaOH,立刻生成沉淀,沉淀达最大后,即铝离子完全反应,继续滴加NaOH,氢氧根与铵根离子反应,沉淀不变,当铵根离子反应完毕,加入的氢氧根与氢氧化铝反应,沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3:1:1,图象A符合,故A正确;
B.离子反应的顺序错误,图为先与铵根离子反应,不符合反应过程,故B错误;
C.未画出铵根离子的反应、生成氢氧化铝沉淀与氢氧化铝溶解消耗的氢氧化钠得到物质的量不符合,故C错误;
D.三阶段消耗NaOH溶液的体积比为3:1:1,图中比例不符合,故D错误;
故选A.
点评 本题考查铝化合物的性质及计算,题目难度中等,明确反应原理为解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
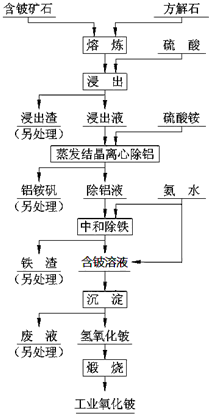 工艺流程如图.
工艺流程如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核中有7个中子的碳原子:12C | |
| B. | 明矾的电离方程式是:KAl(SO4)2•12H2O═K++Al3++2SO42-+12H2O | |
| C. | K+结构示意图: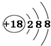 | |
| D. | Ba(OH)2与H2SO4反应的化学方程式是:Ba(OH)2+H2SO4═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者小于后者 | B. | 前者大于后者 | C. | 前者等于后者 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 | |
| B. | 影响化学平衡常数的因素是温度 | |
| C. | 放热反应不一定能自发进行,而吸热反应也可能自发进行 | |
| D. | 熵增大的反应其焓变一定增大,焓变增大的反应其熵不一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加人过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向1molFeBr2溶液中通入 1.5molCl2 :2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 氯化亚铁溶液中通人氯气:Fe2++Cl2═Fe3++2C1- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com