
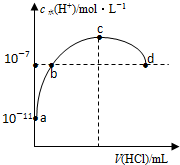
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
分析 A.b、d点溶液中c(H+)=10-5mol/L,常温下c(H+).c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性;
B.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒判断c(NH4+)、c(Cl-)相对大小;
C.a、b之间的任意一点,溶液都呈碱性,结合电荷守恒判断离子浓度大小.
D.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$ mol/L=0.001mol/L,Ka=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$.
解答 解:A.b、d点溶液中c(H+)=10-7mol/L,常温下c(H+).c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性,如果氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,故A错误;
B.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒得c(NH4+)<c(Cl-),故B错误;
C.a、b之间的任意一点,溶液都呈碱性,即c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),故C错误.
D.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$ mol/L=0.001mol/L,Ka=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$mol/L=1×10-5mol/L,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断及识图能力,明确图中曲线变化趋势及每一点溶液中溶质成分及其性质是解本题关键,注意电荷守恒的灵活运用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 25℃时Kb(NH3•H2O)≈10-5 | |
| B. | 滴定过程中水的电离程度一直保持增大趋势 | |
| C. | 为使终点现象更加明显可多加上几滴甲基橙 | |
| D. | 滴定终点时c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
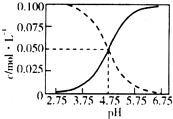 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
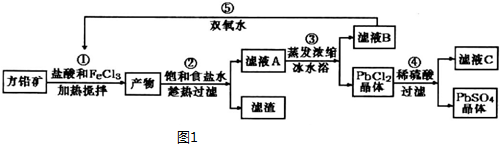
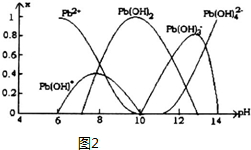
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com