
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(1)4;
(2)①2×10-4mol/(L·min)
②0.02 0.2或0.4 0.4或0.2
(3)①5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
②< 因为HC2O4-的电离程度大于HC2O4-的水解程度
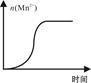
(4)Mn2+对该反应有催化作用
解析试题分析:(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,首先要在一定温度下,用一种浓度的KMnO4酸性溶液和H2C2O4进行实验作对照。然后通过改变KMnO4或H2C2O4的浓度来关系反应的快慢以测定浓度对反应速率的影响;再进行其它的条件不变,通过改变反应温度来测定反应速率,来实现温度对反应速率的影响;最后进行其它条件不变,加入催化剂来观察反应速率的快慢实现催化剂对反应速率的影响的实验。因此至少需要完成4组实验进行对比即可得出结论。(2)①用0.002 mol/L KMnO4酸性溶液进行实验时,Δt=(6.7+6.6+6.7)÷3=20/3min.v(KMnO4)=Δc÷Δt ="0.002" mol/L×4÷(4+2) ÷20/3min=2×10-4mol/(L·min)。②若要得出“褪色时间越短,反应的速率越快”结论应该只改变一个量,其它都相同,观察褪色时间的长短。a=0.02;b=0.2,c=0.4或a=0.02;b=0.4,c=0.2.(3)①由电离平衡常数可知草酸是弱酸。因此根据氧化反应反应的规律及离子方程式的拆写原则可得:草酸与酸性高锰酸钾溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+= 2Mn2++ 10CO2↑+8H2O。②室温下,草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5可知草酸氢根离子的电离作用大于其水解作用,所以溶液呈酸性。pH<7.(4)n(Mn2+)在反应起始时变化不大,速率也变化不大,一段时间后由于n(Mn2+)增多,反应速率快速增大是因为Mn2+对该反应有催化作用。
考点:考查实验方案的设计、离子方程式的书写、多元弱酸的酸式盐的电离与水解及溶液的酸碱性的知识。


科目:高中化学 来源: 题型:填空题
(6分)完成下列反应的离子方程式:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42—恰好完全沉淀:
(2)向明矾溶液中逐滴加入Ba(OH)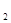 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时:
(3)向Ca(HCO3) 2溶液中加入过量的NaOH溶液:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题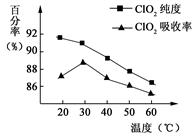
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·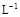 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·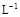 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=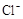 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +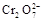 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________;
(2)实验③中的现象为_____________________________________________________;
(3)实验①、②中反应的离子方程式分别是__________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是: 。
(2)A、C形成的四原子核化合物甲的电子式为 ,该化合物呈弱酸性,试写出这种化合物的电离方程式: 。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式: 。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式: 。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式: 。
(6)A、E形成的四原子核化合物丙容易液化,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
| A.Na2S2O3 | B.AlCl3 |
| C.Na2CO3 | D.NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶无色澄清的溶液,其中可能含Na+、Mg2+、H+、Fe3+、CO32-、Cl-、Br-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显橙红色
③将②得到的溶液滴加硝酸银溶液,有白色沉淀生成,滴加稀硝酸沉淀不溶解。
④另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的离子有 。
(2)肯定不存在的离子有 。
(3)可能存在的离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。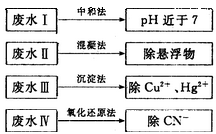
①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含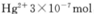 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
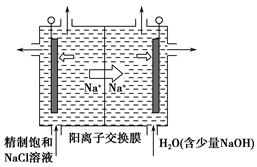
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答: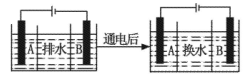
①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com