
分析 A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,则A元素是Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,再结合物质性质解答.
解答 解:A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,则A元素是Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,
(1)通过以上分析知,A是Br元素、B是H元素、C是O元素、D是S元素,
故答案为:Br;H;O;S;
(2)海水提溴的原理是利用Cl2将Br-氧化成Br2,离子方程式为:Cl2+2Br-═2Cl-+Br2,
故答案为:Cl2+2Br-═2Cl-+Br2;
(3)类比Cl2和水反应Cl2+H2O=HCl+HClO,所以Br2可以和H2O反应生成HBr和HBrO两种酸,反应方程式为Br2+H2O=HBr+HBrO,
故答案为:Br2+H2O=HBr+HBrO.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答结构,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析能力及逻辑推理能力.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①②③ | C. | ③④⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| B. | 检测时,电解质溶液中的 H+向负极移动 | |
| C. | 若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气 | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
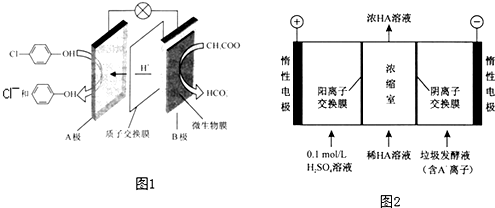
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2OH | B. | 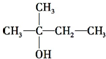 | ||
| C. | 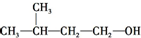 | D. | 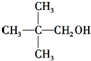 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙醛加入新制氢氧化铜中加热,出现砖红色沉淀 | |
| B. | 将乙醇滴入酸性重铬酸钾溶液中,溶液由橙色变为绿色 | |
| C. | 将二氧化硫通入滴有酚酞的氢氧化钠溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口久置,颜色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
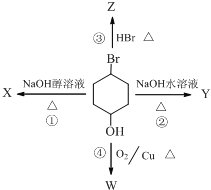 如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
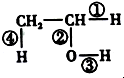 (1)在烷烃分子中,每增加一个碳原子,1mol 烷烃完全燃烧需要多消耗氧气(填字母)B.
(1)在烷烃分子中,每增加一个碳原子,1mol 烷烃完全燃烧需要多消耗氧气(填字母)B.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com