

请完成下列问题:
(1)为什么要在酸性条件下而不能在碱性条件下氧化Br-?原因是______________________。
(2)氧化后生成的单质溴为什么可以用热空气吹出?原因是__________________________。
(3)用热空气吹出的Br2用SO2和水吸收,写出这一反应的化学方程式,并标出电子转移的方向和数目:__________________________________________________________________
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出各步反应的化学方程式。(提示:第③步反应中生成物有硫酸钠)
(2)经分析海水中含溴0.006 5%,则海水中含NaBr的质量分数是多少?试计算多少吨海水可制得1.0 t溴?(假设提取过程中溴无损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
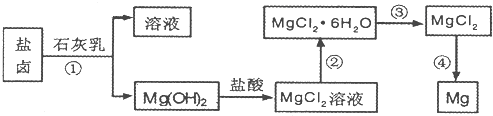
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是__________________
____________________________________________________________________。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有___________溶液的烧杯中,充分搅拌后经___________、___________(填操作方法)可得纯净的Mg(OH)2。
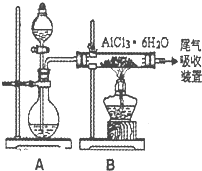
(3)下图是该兴趣小组设计进行过程③的实验装置图:

A
其中装置A的作用是_______________________________________________________。
(4)写出过程④中发生反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源:2011届福建省厦门市双十中学高三上学期期中考试化学试卷 题型:填空题
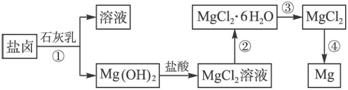
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校研究性学习小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题: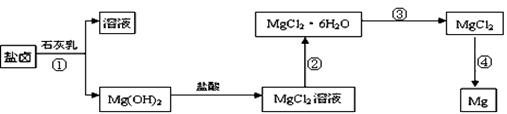
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 饱和溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。写出有关反应的离子方程式 。
(2)右图是该校研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是 。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是 。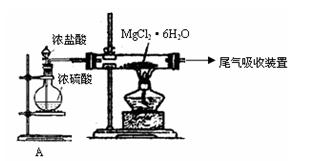
(3)写出过程④中发生反应的化学方程式 。该过程得到的镁蒸气需要在特定的循环中冷却,应选用 (填试剂名称)作冷却剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com