
【题目】铅蓄电池反应为:Pb + PbO2 + 2H2SO4![]() 2PbSO4 + 2H2O 。下列说法中正确的是
2PbSO4 + 2H2O 。下列说法中正确的是
A. PbO2得电子,被氧化
B. 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g
C. 电流是由PbO2经外电路流向Pb
D. 电池放电时,溶液酸性增强
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列事实与盐类水解无关的是( )
A.明矾可以净水
B.使用热的纯碱溶液去除油污效果好
C.实验室配制 FeCl2 溶液时加入少量稀盐酸
D.向 FeCl3 溶液中加入 KOH 溶液产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。
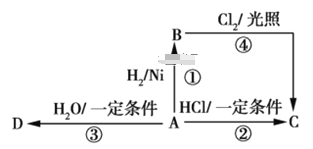
根据图回答下列问题。
(1) 写出A、B、C、D的结构简式:
A_______,B_______,
C_______,D_______。
(2)写出②、④两步反应的化学方程式,并注明反应类型:②_______________,反应类型_________;
④__________________________,反应类型______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,研究NO2, NO,CO,SO2 等大气污染物和温室效应的治理对建设美丽中国具有重要意义。
(1)已知:NO2(g)+CO(g) ![]() CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2, | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)═2NO(g)△H=+179.5kJmol1 k2
③2NO(g)+O2(g)═2NO2(g)△H=112.3kJmol1 k3
写出NO与CO反应生成无污染气体的热化学方程式为____________.该热化学方程式的平衡常数K为______________(用K1。K2。K3表示)。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)在体积可变的恒压密闭容器中充入1molCO2与足量的碳,让其发生反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

T℃时,若容器中充入惰性气体,v正 ______ v逆(填<,>,=),平衡______移动(填正向,逆向或不。下同),若充入等体积的CO2和CO,平衡_________移动。
650℃时,反应达平衡后CO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。

(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____。酸浸时,硫酸过量的目的是:①____;②____。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____。CaCO3用量过大,对MnSO4·H2O产量的影响是,____(填“升高”“降低”或“无影响”)。
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____,使固体MnSO4·H2O与溶液分离,____、真空干燥。
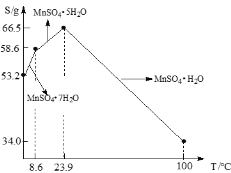
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE, D的单质是黄绿色气体,常温下E的单质是液体。
请回答:
(1)B在周期表中的位置__________,C的原子结构示意图是__________。
(2)E单质的化学式是___________。
(3)上述五种元素中,所形成的最高价氧化物对应的水化物的酸性最强的物质是_____(化学式)。
(4)写出C的氧化物与A的最高价氧化物对应的水化物反应的离子方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯具有良好的镇咳、祛痰、抑菌作用,其结构如图所示。下列关于柠檬烯的说法正确的是
![]()
A. 1 mol柠檬烯只能与1 mol H2反应
B. 能发生取代反应和加成反应
C. 属于乙烯的同系物
D. 不能使酸性高锰酸钾褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com