
【题目】《Journal of Energy Chemistry》杂志曾报道我国科学家设计的CO2熔盐捕获与转化装置,其示意图如下:
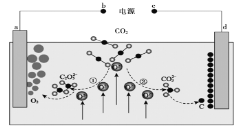
下列有关说法正确的是( )
A.d为负极
B.①②中,捕获CO2时碳元素的化合价发生了变化
C.转移1 mol电子可捕获CO2气体22.4 L
D.a极电极反应式为![]()
【答案】D
【解析】
由图可知,反应①为CO2与O2—反应生成C2O52—,C2O52—失电子发生氧化反应生成氧气和二氧化碳,a极为阳极,b极为正极,反应②为CO2与O2—反应生成CO32—,CO32—得电子发生还原反应生成C,d极为阴极,c极为负极,总反应为二氧化碳在熔融盐中电解生成碳和氧气。
A项、由图可知,反应①为CO2与O2—反应生成C2O52—,C2O52—失电子发生氧化反应生成氧气和二氧化碳,则a极为阳极,与a极相连的b极为正极,故A错误;
B项、反应①为CO2与O2—反应生成C2O52—,反应②为CO2与O2—反应生成CO32—,CO2与C2O52—和CO32—中C元素化合价均为+4价,碳元素的化合价没有变化,故B错误;
C项、没有明确是否为标准状况,无法计算二氧化碳的体积,故C错误;
D项、由图可知,反应①为CO2与O2—反应生成C2O52—,C2O52—在a极失电子发生氧化反应生成氧气和二氧化碳,电极反应式为![]() ,故D正确;
,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】阿司匹林(![]() )是有机合成过程中的中间体。
)是有机合成过程中的中间体。

已知:Ⅰ.![]()
Ⅱ.![]() (具有较强的还原性)
(具有较强的还原性)
(1)反应④的试剂和条件为______;反应①的反应类型为______;反应②的作用是_____;
(2)B的结构简式为_______;
(3)下列关于G的描述正确的是______;
A.具有两性,既能与酸反应也能与碱反应
B.能发生加成、消去、取代和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_______;反应②的化学方程式为_________;
(5)符合下列条件的C的同分异构体
a.属于芳香族化合物,且含有两个甲基
b.既能发生银镜反应又能发生水解反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
Ⅰ.工业生产纯碱的工艺流程示意图如图:
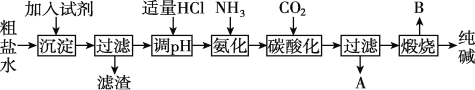
(1)为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是____。
A.碳酸钠、氢氧化钠、氯化钡
B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡
D.氯化钡、氢氧化钠、碳酸钠
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是____;碳酸化时没有析出碳酸钠晶体,其原因是____。
(3)碳酸化后过滤,滤液A最主要的成分是____(填写化学式),检验这一成分的阴离子的具体方法是____。
(4)煅烧制取Na2CO3在____(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
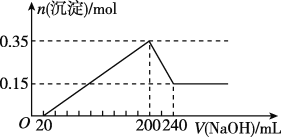
(1)原混合物中Mg和Al的质量之比为____。
(2)生成的H2在标准状况下的体积为____。
(3)加入NaOH溶液的物质的量浓度为____。
(4)稀硫酸的物质的量浓度为____。
(5)写出NaOH体积在200-240mL之间所发生的离子反应方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯分子中至少有16个原子共平面
C. 对三联苯的一氯取代物有4种
D. 0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。如图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
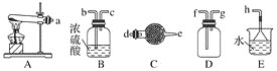
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接__、___接__,__接h;实验室用A装置制取NH3的化学方程式为___。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是___,试写出制纳米级碳酸钙的化学方程式:___。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是
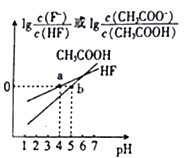
A. 常温下,Ka(CH3COOH)=10-5
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaF溶液的pH小于0.1mol/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中, 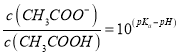
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是
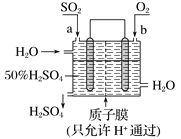
A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com