
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 强氧化剂与强还原剂不一定能发生氧化还原反应 | |
| D. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 |
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
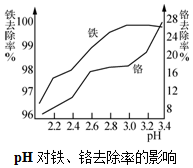 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的钠保存在煤油中 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 新制的氯水保存在棕色玻璃瓶中 | |
| D. | 氢氧化钠溶液保存在具玻璃塞的玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L Cl2与4.25 g NH3所含有的原子数一定相等 | |
| B. | 标准状况下36 g H2O与1.204×1024个O2分子所占的体积 | |
| C. | 100 mL 0.1 mol/L AlCl3溶液中,Al3+个数为0.01NA | |
| D. | 0.1 mol NH${\;}_{2}^{-}$所含电子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液的本质区别是能否发生丁达尔效应 | |
| B. | 胶体加入某些盐可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象,溶液也能发生丁达尔现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com