
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: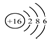 | ||
| C. | 过氧化钠的电子式: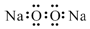 | D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
分析 A、氯乙烯是用一个氯原子取代了乙烯中的一个H原子形成的;
B、硫原子的核内有16个质子,核外有16个电子;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、将质量数写在原子符号的左上角.
解答 解:A、氯乙烯是用一个氯原子取代了乙烯中的一个H原子形成的,故结构简式为CH2=CHCl,故A错误;
B、硫原子的核内有16个质子,核外有16个电子,故结构示意图为 ,故B正确;
,故B正确;
C、过氧化钠由2个钠离子和1个过氧根构成,故过氧化钠的电子式为 ,故C错误;
,故C错误;
D、将质量数写在原子符号的左上角,质量数=质子数+中子数=10+8=18,故原子符号为188O,故D错误.
故选B.
点评 本题考查了结构简式、原子结构示意图、电子式和原子符号的书写,难度不大,应注意的是离子化合物和共价化合物电子式书写的区别.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数为78 | B. | 质子数为53 | C. | 核外电子数为131 | D. | 中子数为53 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
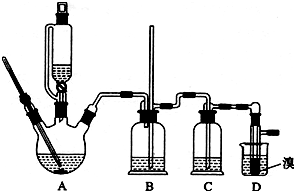
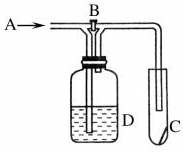 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓NaI溶液 | B. | 浓NaOH溶液 | C. | 饱和NaCl溶液 | D. | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
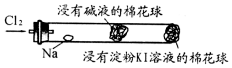 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃| A. | 钠着火燃烧产生苍白色火焰和白烟 | |
| B. | 白烟是氯化钠微晶分散在空气中形成 | |
| C. | 玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境 | |
| D. | 根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
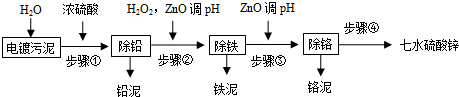
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |
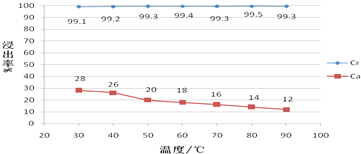
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/°C | 78.5 | 132 | 34.6 |
| 熔点/°C | -130 | 9 | -116 |
查看答案和解析>>
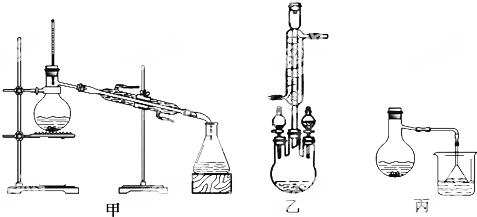
科目:高中化学 来源: 题型:实验题
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com