
【题目】利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为_________。
②常温下,不能与M 单质发生反应的是_________(填序号)。
a. CuSO4 溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气有多种方法,电化学法是其中之一。
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是_____________;反应池中发生反应的化学方程式为_______________________________________。
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。

【答案】 ![]() b e 增大反应物接触面积,使反应更充分 H2S+2FeCl3=2FeCl2+S↓+2HCl 2Fe2++2H+
b e 增大反应物接触面积,使反应更充分 H2S+2FeCl3=2FeCl2+S↓+2HCl 2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
【解析】试题分析:本题考查原子结构示意图的书写,Al的性质,化学方程式的书写,电解原理和电解方程式的书写。
(1)①根据“K2O·M2O3·2RO2·nH2O”知M的化合价为+3价,R的化合价为+4价;元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则M为13号元素Al,R为14号元素Si,Si的原子结构示意图为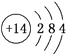 。
。
②M为Al。a,Al与CuSO4溶液发生置换反应:2Al+3CuSO4=Al2(SO4)3+3Cu,常温下能反应;b,Al与Fe2O3高温下发生铝热反应,常温下Al与Fe2O3不反应;c,常温下Al遇浓硫酸发生钝化形成致密的氧化膜;d,常温下Al与NaOH溶液反应生成NaAlO2和H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;e,常温下Al与Na2CO3固体不反应;常温下不能与Al反应的是Fe2O3、Na2CO3固体,答案选be。
(2)反应池中反应物的流向采用气、液逆流方式的目的是:增大反应物接触面积,使反应更充分。根据图示,反应池中反应为FeCl3溶液与H2S反应生成S沉淀,H2S被氧化成S,FeCl3被还原成FeCl2,反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl。反应后的溶液为FeCl2和HCl的混合液,反应后的溶液进入电解池进行电解生成Fe3+和H2,阳极反应式为Fe2+-e-=Fe3+,阴极反应式为2H++2e-=H2↑,电解总反应的离子方程式为2Fe2++2H+![]() 2Fe3++H2↑。
2Fe3++H2↑。


科目:高中化学 来源: 题型:
【题目】某实验小组同学利用下图装置对电化学原理进行了一系列探究活动。

(1)甲池为装置_______(填“原电池”或“电解池”)。
(2)甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过_________mol电子。
(3)实验过程中,甲池左侧烧杯中NO3-的浓度_______(填“变大”、“变小”或“不变”)。
(4)其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量___________(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为___________________________________,工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:

已知:羰基化合物可发生以下反应:

(注:R'可以是烃基,也可以是H原子)
回答下列问题:
(1)A分子中官能团的结构简式为____________,分子结构鉴定时,获取官能团信息的仪器是____________。
(2)B生成C的反应类型为____________。
(3)核磁共振氢谱表明D只有一种化学环境的氢,D的结构简式为_________,分子中最多有_______个原子共平面。
(4)E发生酯化、脱水反应生成F的化学方程式为_____________________________。
(5)F的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的结构简式为____________。
(6)聚丙烯酸钠(![]() )是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。_______________________________________________________
)是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。_______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3 + CaCl2=CaCO3 ↓ + 2NaCl B. Cl2 + 2KI=2KCl + I2
C. 2NaHCO3 ![]() Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三锰(Mn3O4)是电子工业的磁性材料,而氯化铅(PbCl2)常用于焊料和助溶剂、制备其他铅盐等。用方铅矿精矿(主要成分为PbS)和软锰矿(主要成分是MnO2,还含有Fe2O3、Al2O3等杂质)制备PbCl2和Mn3O4的工艺流程如下:

已知:PbCl2(s) + 2Cl-(aq) ![]() PbCl42- ( aq) ΔH > 0
PbCl42- ( aq) ΔH > 0
(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有________(写出一条即可)。
(2)试剂X是___________。(填“化学式”)
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为___________。
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是___________。
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为___________。
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn 时,理论上消耗金属铝的质量最少为___________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1NH3·H2O 溶液中有如下电离平衡:NH3·H2O ![]() NH4++OH- 对于该平衡,下列叙述正确的是
NH4++OH- 对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向逆反应方向移动
C.加入少量 0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍.则下列判断正确的是( )
A.两种单质的摩尔质量比为1:4
B.生成物C中A的质量分数为75%
C.生成物C中A,B的原子个数比为3:1
D.反应前后气体分子数比为1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com