
【题目】下列物质的每步转化在给定条件下能一步实现且较合理的是 ( )
A. ![]()
B. ![]()
C. ![]()
D. ![]()
【答案】B
【解析】
A.碱式碳酸铜和硫酸反应生成硫酸铜溶液,钠是活泼金属在溶液中先和水反应生成氢氧化钠和氢气;B.饱和食盐水中通入氨气和二氧化碳生成碳酸氢钠,碳酸氢钠分解生成碳酸钠;C.硫化氢不完全燃烧生成硫和水,硫燃烧生成二氧化硫,二氧化硫催化下与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸;D.硅与氢氧化钠溶液反应生成硅酸钠和氢气,硅酸钠高温条件下得不到二氧化硅,二氧化硅与氢氟酸反应生成四氟化硅。
A.钠是活泼金属和盐溶液反应先与水分与生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,不能在溶液中置换铜,选项A错误;
B.向氨化的饱和氯化钠溶液中通入二氧化碳反应生成碳酸氢钠晶体和氯化铵,碳酸氢钠受热分解生成碳酸钠,能一步实现,选项B正确;C.硫化氢不完全燃烧生成硫和水,硫燃烧生成二氧化硫而不能直接得到三氧化硫,二氧化硫催化下与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸,选项C错误;D.硅与氢氧化钠溶液反应生成硅酸钠和氢气,硅酸钠高温条件下得不到二氧化硅,二氧化硅与氢氟酸反应生成四氟化硅,选项D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】某课外兴趣小组需要用 18 mol/L 的浓硫酸配制80mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL, 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。
A.10 mL B.25 mL C.50 mL D.100 mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(3)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )
A. 10∶1 B. 1∶10
C. 1∶100 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是
A. ![]() 与
与![]() 得电子能力相同
得电子能力相同
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、 S2-、 Ca2+、 K+半径逐渐减小
D. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g) ![]() Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )

A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓝色荧光材料D的合成路线如下:
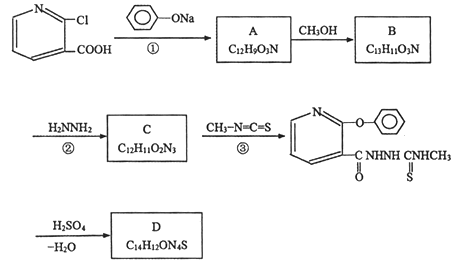
已知:
Ⅰ.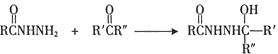
Ⅱ.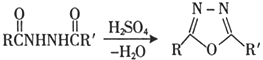
回答下列问题:
(1)①的反应类型为________。
(2)反应②的另一产物为甲醇,其化学方程式为________。
(3)下列说法正确的是________。
A.1molA最多能与7molH2加成 B.化合物B能与FeCl3溶液发生显色反应
C.化合物C具有碱性 D.化合物D的结构简式为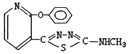
(4)写出同时符合下列条件的化合物![]() 的同分异构体结构简式________。
的同分异构体结构简式________。
①含苯环;②1H-NMR谱表明分子中有2种氢原子。
(5)设计以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。下列说法不正确的是( )
A. C、D、G三种元素形成的盐,水溶液可能呈碱性
B. A与B能形成离子化合物A5B,且既含有离子键又含有共价键
C. B、C、G的简单氢化物中C的氢化物稳定性最强
D. D、E、F、G形成的简单离子半径逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com