
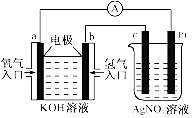
 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )| A. | 该装置中Pt极为阳极 | |
| B. | 当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L | |
| C. | 该装置中b极的电极反应式是:H2+2OH--2e-=2H2O | |
| D. | 该装置中a极为正极,发生氧化反应 |
分析 左边装置是原电池,通入氢气电极b为负极,电极反应为H2-2e-+2OH-=2H2O,通入氧气的电极为正极,电极反应为O2+4e-+2H2O=4OH-,右侧装置为电解池,C棒为阴极,电极反应为Ag++e-=Ag,铂丝为阳极,电极反应为4OH--4e-=O2↑+2H2O,据此分析解答.
解答 解:左边装置是原电池,通入氢气电极b为负极,电极反应为H2-2e-+2OH-=2H2O,通入氧气的电极为正极,电极反应为 O2+4e-+2H2O=4OH-,右侧装置为电解池,C棒为阴极,电极反应为 Ag++e-=Ag,铂丝为阳极,电极反应为4OH--4e-=O2↑+2H2O,
A.通过以上分析知,Pt为阳极,故A正确;
B.当c极生成单质银,质量变化为2.16g,所以物质的量为:$\frac{2.16g}{108g/mol}$=0.02mol,所以a极上消耗的O2的物质的量为0.005mol;标准状况下的体积为0.112L,故B错误;
C.b电极上氢气失电子和氢氧根离子反应生成水,电极反应为H2-2e-+2OH-=2H2O,故C正确;
D.通入氧气的电极为正极,正极上得电子发生还原反应,故D错误;
故选BD.
点评 本题考查了原电池和电解池原理,根据得失电子判断正负极,明确各个电极上发生的反应是解本题关键,注意气体摩尔体积的适用范围及适用条件,为易错点.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含离子键的化合物一定是离子化合物 | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | 含共价键的化合物不一定是共价化合物 | |
| D. | 在离子化合物中也可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn|H2SO4(稀)|C | B. | Cu|AgNO3(aq)|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
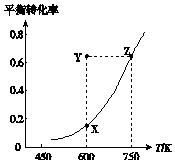 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )| A. | △H<0 | B. | 从Y点到Z点可通过升高温度实现 | ||
| C. | 从Y点到X点可通过使用催化剂实现 | D. | 600 K时,Y点甲醇的v正<v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
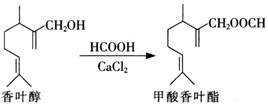
| A. | 香叶醇分子中含有1个手性碳原子 | |
| B. | 香叶醇可发生消去、加成、氧化反应 | |
| C. | 1 mol甲酸香叶酯可以与1molNaOH反应 | |
| D. | 甲酸香叶酯分子中所有碳原子均可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com