
下列说法正确的是( )
A.pH<7的溶液不一定是酸溶液
B.常温下,pH=5的溶液和pH=3的溶液相比,前者[OH-]不一定是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.在1 mol·L-1的氨水中,改变外界条件使[NH4+]增大,则溶液的pH一定减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法不正确的是(双选)( )
A.FeCl3、Na2O2、CuS均可由相应单质直接化合生成
B.向稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉溶解
C.“溶洞”的形成过程中发生了碳酸钙与水、CO2的反应
D.氢氧化铝、碳酸铵能与盐酸反应,不能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是( )
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
菱锰矿的主要成分是MnCO3(含有少量FeS2、Al2O3),以菱锰矿为原料制备锰单质的流程如下所示:

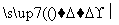 浆化
浆化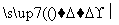 溶液1
溶液1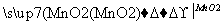 溶液2
溶液2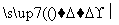 精制—→电解—→Mn
精制—→电解—→Mn
请回答下列问题:
(1)菱锰矿在浸取前需要粉碎,其目的是______________________________。
(2)用稀硫酸浸取时,主要反应的离子方程式为____________;加入二氧化锰时被氧化的物质是____________(填化学式)。
(3)已知Fe、Al、Mn的氢氧化物开始沉淀及沉淀完全时的pH如表所示,则加氨水沉淀时应控制溶液的pH范围为______________。此时得到的沉淀是____________、__________(填化学式)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀pH | 1.8 | 4.1 | 8.3 |
| 完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)电解硫酸锰溶液时,阴极的电极反应式为____________________。用酸性高锰酸钾溶液检验Mn2+,产生黑色沉淀,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
当CH3COOH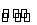 H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
A.CH3COONa B.NH3·H2O C.HCl D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下纯水的pH=6。
(1)pH=7的溶液呈__________(填“酸性”“中性”或“碱性”);
(2)该温度下0.1 mol·L-1的盐酸溶液的pH=__________;
(3)0.05 mol·L-1的Ba(OH)2溶液的pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是( )
A.1×1014 B.55.6×107
C.1×107 D.55.6
查看答案和解析>>
科目:高中化学 来源: 题型:
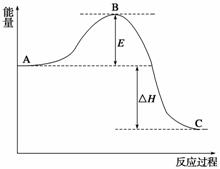
2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?__________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_________________________________________________________;
(2)图中ΔH=__________kJ·mol-1;
(3)V2O5的催化循环机理可能为V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:________________________________________________________________________;
(4)已知常温下,1 mol固体硫燃烧生成二氧化硫气体时放出的热量是296 kJ,计算由S(s)生成3 mol SO3(g)的ΔH________(要求写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
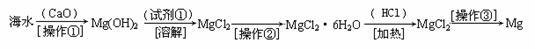
回答下列问题:
(1)写出在海水中加入氧化钙生成氢氧化镁的化学方程式
;
(2)操作①主要是指 ;试剂①可选用 ;
(3)操作②是指 ;经操作③最终可得金属镁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com