
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有弱碱性和强还原性.工业上利用尿素[CO(NH2)2]、NaC1O在NaOH溶液中发生反应生成水合肼(N2H4H2O)、Na2CO3等产物.请回答:
(1)上述生成水合肼的反应中尿素是( 填“氧化剂”或“还原剂”),反应的化学方程式为 .
(2)肼与盐酸反应可生成N2H6C12 , N2H6C12的水溶液显性( 填“酸”或“碱”或“中”),用离子方程式表示其原因 .
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式 .
若要设计实验方案检验上述反应生成固体产物中的金属离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中;
②
【答案】
(1)还原剂;CO(NH2)2+NaClO+2NaOH=N2H4?H2O+Na2CO3+NaCl
(2)酸;N2H62++2H2O?N2H4?2H2O+2H+
(3)3N2H4+2Fe2O3 ![]() 3N2+4Fe+6H2O;先加入双氧水、再加硫氰化钾
3N2+4Fe+6H2O;先加入双氧水、再加硫氰化钾
【解析】解:(1)尿素和次氯酸钠﹣氢氧化钠溶液反应生成肼、碳酸钠、氯化钠、水,该化学反应方程式为CO(NH2)2+NaClO+2NaOH=N2H4H2O+Na2CO3+NaCl,该反应中:CO(NH2)2中N(﹣3)→N2H4H2O中N(﹣2)为还原剂,NaClO中Cl(+1→﹣1)为氧化剂,所以答案是:还原剂;CO(NH2)2+NaClO+2NaOH=N2H4H2O+Na2CO3+NaCl;(2)N2H6C12为强酸弱碱盐,水解呈酸性,水解方程式为:N2H62++2H2ON2H42H2O+2H+ ,
所以答案是:酸;N2H62++2H2ON2H42H2O+2H+;(3)肼与氧化铁在高温条件下反应生成氮气、水、铁单质,方程式为:3N2H4+2Fe2O3 ![]() 3N2+4Fe+6H2O,
3N2+4Fe+6H2O,
所以答案是:3N2H4+2Fe2O3 ![]() 3N2+4Fe+6H2O;②铁与盐酸反应生成氯化铁和氢气,离子方程式为Fe+2H+═Fe2++H2↑,检验亚铁离子,双氧水能氧化亚铁离子生成铁离子,铁离子能与硫氰化钾反应生成血红色物质,
3N2+4Fe+6H2O;②铁与盐酸反应生成氯化铁和氢气,离子方程式为Fe+2H+═Fe2++H2↑,检验亚铁离子,双氧水能氧化亚铁离子生成铁离子,铁离子能与硫氰化钾反应生成血红色物质,
所以答案是:Fe+2H+═Fe2++H2↑;先加入双氧水、再加硫氰化钾.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学反应的本质是旧的化学断裂新的化学键形成,即有新物质的生成,下列变化属于物理变化的是
A.石油的分馏B.煤的干馏
C.氧气变臭氧D.乙烯通入溴水,溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如图),有关说法正确的是( ) 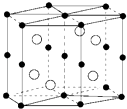
A.锰价电子排布为3d74s0
B.Bi是d区金属
C.该晶体的化学式为MnBi
D.该合金堆积方式是简单立方
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A.CH3CH=CH2+Br2 ![]() CH3CHBrCH2Br
CH3CHBrCH2Br
B.CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质递变错误的是
A.Li、Be、B原子最外层电子数逐渐增多B.N、O、F氢化物的稳定性依次减弱
C.P、S、Cl最高正价依次升高D.Li、Na、K的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( ) 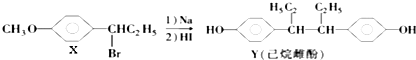
A.在NaOH水溶液中加热,化合物X可发生消去反应
B.在一定条件下,化合物Y可与Br2发生加成反应
C.用FeCl3溶液可鉴别化合物X和Y
D.化合物Y中不含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下: CH3CH2OH ![]() CH2=CH2
CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示: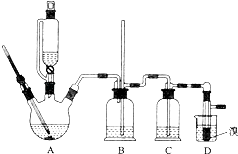
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母) a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收A中反应可能生成的酸性气体:(填正确选项前的字母) a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是;
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);
(5)若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母) a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿佛加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为()
A. 2molL-1 B. 2.5molL-1 C. 5molL-1 D. 7.5molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com