
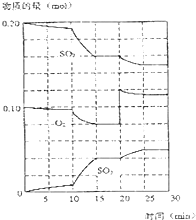
 在一定条件下,二氧化碳和氧气发生如下反应:
在一定条件下,二氧化碳和氧气发生如下反应:

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、金具有极高的抗腐蚀性、优良的导热、导电性 |
| B、银可用作有机合成催化剂、电池等材料 |
| C、Cu属于不活泼金属,在潮湿的空气中不易被腐蚀 |
| D、铜具有良好的导电性,大量用于制造电线、电缆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体中,只存在离子键,不可能存在其它化学键 |
| B、在氧族元素(O、S、Se、Te)的氢化物中,水的沸点最低 |
| C、NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:2 |
| D、晶体的熔点:金刚石>碳化硅>单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 装置 | 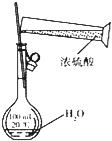 |
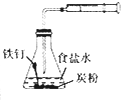 |
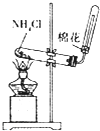 |
 |
| 目的 | 配制稀硫酸 | 探究铁的吸氧腐蚀 | 实验室制备氨气 | 除去乙烯中的乙烷 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
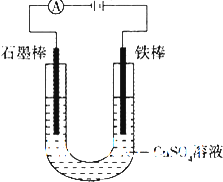 如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )
如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )| A、转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C、电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D、若将石墨棒换成铜棒,可实现铁制品上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋、味精--调味品 |
| B、酒精、汽油--易燃液体 |
| C、Na+、Fe3+--人体所需微量元素 |
| D、废塑料瓶、铝制易拉罐--可回收垃圾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com