
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定需要加热,放热反应一定不需要加热 | |
| B. | 甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | 常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ/mol | |
| D. | S (s)+O2(g)=SO2(g)△H1=-Q1 kJ/mol S (g)+O2(g)=SO2(g)△H2=-Q2 kJ/mol,则Q1<Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
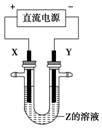 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 若Z是稀硫酸,X为铜,Y为铁,则铁不溶解,该方法为外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤①②③④⑥⑦ | B. | ③⑤①②⑥⑦④ | C. | ③⑤②⑦①⑥④ | D. | ②⑥⑦①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com