
【题目】下列物质属于盐的是
A. Al2O3 B. NaOH C. NH4Cl D. HCl
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有淀粉溶液、鸡蛋清、葡萄糖溶液,区别它们时,下列试剂和对应现象依次是( )
试剂:①新制的Cu(OH)2 ②碘水 ③浓硝酸
现象:a.变蓝色 b.红色沉淀 c.变黄色
A. ②—a、①—c、③—b B. ③—a、②—c、①—b
C. ②—a、③—c、①—b D. ②—c、③—a、①—b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用以下装置探究SO2的某些化学性质。
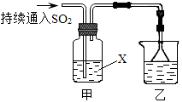
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);
若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 ;
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
![]() Ca2++
Ca2++![]() ClO-+
ClO-+![]() SO2+
SO2+![]() H2O=
H2O=![]() CaSO4↓+
CaSO4↓+![]() Cl-+
Cl-+![]() SO42-+
SO42-+![]() 。
。
Ⅱ.某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
i.取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(4)搅拌的目的是 。
(5)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是 。
ii.准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用滴定法测得n(H+)=3.000×10-5 mol。
(6)在此实验温度下,PbI2的溶度积常数Ksp= 。若步骤i盛装滤液的烧杯中有少量水,Ksp测定结果将会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,80℃时反应:2NO(g)+O2(g)![]() 2NO2(g),反应体系中,n(NO)随时间t的变化如下表
2NO2(g),反应体系中,n(NO)随时间t的变化如下表
时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
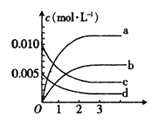
(1)如图表示NO2变化曲线的是________。(填字母)。用O2表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ _。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
e.等温等容时,充入氦气
f.等温等压时充入氦气
(4)若将2molNO和1molO2充入两个密闭容器中,保持一定温度进行反应:
2NO(g)+O2(g)![]() 2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
(5)如果按物质的量之比为2:1充入NO和O2的混合气体,则达到平衡时NO与O2的转化率 之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A. H2SO4、HNO3、CH3COOH 均属于酸
B. NO、CO、NO2均属于酸性氧化物
C. NaCl、CuSO4、NH3·H2O均属于盐
D. H2S、HCl、NH3均属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B均为短周期元素,它们的离子A﹣和B2+具有相同的核外电子层结构.下面说法正确的是( )
A.原子序数A>B
B.核外电子数为B>A
C.原子半径A>B
D.离子半径 B2+>A﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<O
2CO2(g)+N2(g)△H<O
①反应的速率时间罔像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是 (填对应字母).
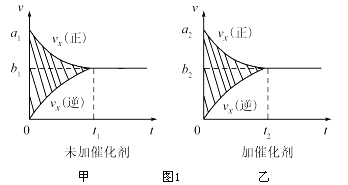
A.a1>a2
B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
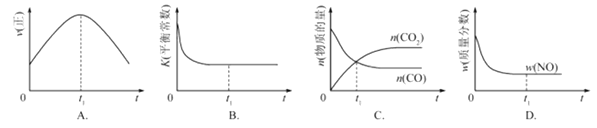
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: .
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是 反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K= .
CO+3H2的平衡常数K= .
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
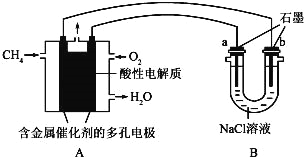
①甲烷燃料电池的负极反应式:
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com