
【题目】下述实验不能达到预期实验目的的是( )

A.AB.BC.CD.D
【答案】D
【解析】
A. 硝酸银溶液中滴加氯化钠溶液至不再有沉淀,其离子反应方程式为:Ag++Cl-=AgCl↓,再滴加硫化钠溶液,其离子反应方程式为:
2AgCl+S2-=Ag2S+2Cl-,证明溶解度Ag2S比AgCl更小,A正确;
B. 氢氧化镁固体溶解时存在溶解沉淀平衡,Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),加入氯化铵溶液,NH4+消耗OH-,使平衡正向移动,促进氢氧化镁固体的溶解,B正确;
Mg2+(aq)+2OH-(aq),加入氯化铵溶液,NH4+消耗OH-,使平衡正向移动,促进氢氧化镁固体的溶解,B正确;
C. 甲基橙的变色范围是pH≤3.1时变红,3.1~4.4时呈橙色,pH≥4.4时变黄,醋酸中加入甲基橙,加热,观察颜色变化,证明升温促进醋酸的电离,C正确;
D. 淀粉水解后生成葡萄糖,淀粉遇碘水变蓝,若不变蓝,则淀粉水解完全,则在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,冷却加入碘水,可验证淀粉是否水解完全,D错误;故答案为:D。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应式为____________________,负极反应式为___________________;若在常温下转移2mol电子,可产生水质量为_________g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L(标准状况)气体。此时氢氧燃料电池中消耗H2的质量是_______,混合溶液中NaOH的物质的量浓度是__________mol·L-1。
(3)已知可逆反应:AsO43-+2I-+2H+![]() AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
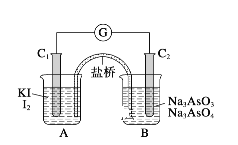
(Ⅰ)若向B中逐滴加入浓盐酸,上述反应向右进行,发现检流计指针向左偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现检流计指针与(Ⅰ)中偏转方向相反。
试回答问题:
操作(Ⅰ)中,C1棒上的反应式为_____________________________。
操作(Ⅱ)中,C2棒上的反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分:
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | ⑧ | ||||||||||||||
Fe | |||||||||||||||||
Ⅰ.用化学用语回答下列问题:
(1)①、②、⑥形成的化合物中存在的化学键类型有________。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。
(3)写出②的离子结构示意图为__________。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。Y的水溶液与洁厕灵混合使用会产生一种有毒气体,该反应的离子方程式为_______。
Ⅱ.A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
![]()
(1)若A是一种金属单质,C是淡黄色固体,写出C的一种用途_____;
(2)若A、B、C均为化合物且含有同一种金属元素,D是会造成温室效应的一种气体,请写出D的电子式_____,A和C反应的离子方程式 ___。
(3)若D是一种常见的过渡金属单质,原子核内有26个质子,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可通过下列流程回收废旧锂离子电池正极材料(LiCoO2,含少量Al、Fe)中的钴和锂。
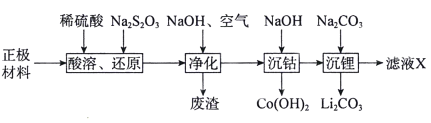
回答下列问题:
(1)“酸溶、还原”过程中S2O32-转化为SO42-,LiCoO2参与反应的离子方程式为____________________________________。
(2)“废渣”的主要成分为___________________。
(3)“沉钴”过程中,当溶液的pH=10时,c(Co2+)=______mol· L-1(已知常温下KSP[Co(OH)2]=1.58×10-15)。
(4)在空气中加热Co(OH)2,固体残留率随温度的变化如图所示。

290℃时,完全脱水变为Co2O3,反应的化学方程式为_______________;500℃时的主要产物为_____________(填化学式);将1000℃时的分解产物1mol与2.2mol Na2O(稍过量)在充氩封闭管中共热,会生成鲜红色的晶体,该晶体的阴离子为正三角形结构,晶体的化学式为__________________。
(5)“滤液X”中最主要的溶质是_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含铁废铜制备胆矾的流程如下图所示:
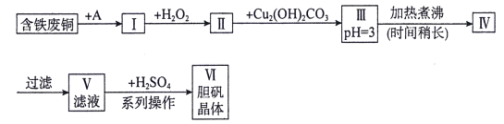
下列说法错误的是( )
A.物质A可选用盐酸
B.I中加H2O2的目的是溶解铜并将Fe2+氧化为Fe3+
C.长时间煮沸Ⅲ中悬浊液的目的是充分聚沉Fe(OH)3
D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。下列说法错误的是( )

A.装置A烧瓶内的试剂可以是KMnO4
B.装置B具有除杂和贮存气体的作用
C.实验结束后,振荡D会观察到液体分层且下层呈紫红色
D.利用该装置能证明氯、溴、碘的非金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )
A.已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
B.由C(石墨,s)![]() C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件的ΔH不同
2HCl(g)在光照和点燃条件的ΔH不同
D.化学变化不一定都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。
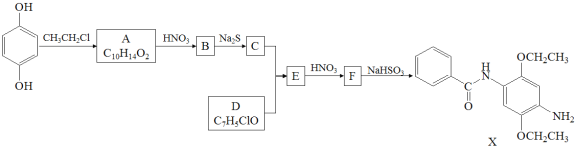
已知: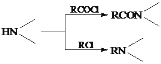 ;
;![]()
请回答:
(1)下列说法正确的是____________。
A.化合物A能与FeCl3溶液发生显色反应 B.化合物C具有弱碱性
C.化合物F能发生加成、取代、还原反应 D.X的分子式是C17H22N2O3
(2)化合物B的结构简式是___________________________________________________。
(3)写出C+D→E的化学方程式_____________________________________________________。
(4)写出化合物A(C10H14O2)同时符合下列条件的同分异构体的结构简式_____________________________。
1H-NMR谱和IR谱检测表明:①分子中有4种化学环境不同的氢原子;②分子中含有苯环、甲氧基(-OCH3),没有羟基、过氧键(-O-O-)。
(5)设计以CH2=CH2和![]() 为原料制备Y(
为原料制备Y(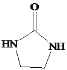 )的合成路线(用流程图表示,无机试剂任选)
)的合成路线(用流程图表示,无机试剂任选)
_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com