
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。

I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:

(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度不再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
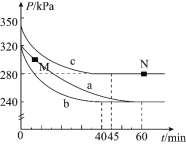
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
【答案】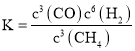 Ⅲ 大于 高温 D
Ⅲ 大于 高温 D ![]()
![]()
![]() 使用催化剂 增大压强
使用催化剂 增大压强 ![]() 增大
增大
【解析】
Ⅰ固相和气相均存在的反应,固相的浓度项不列入化学平衡常数表达式;根据图中Ⅰ、Ⅱ、Ⅲ图象,![]() 百分含量随温度的变化解答;根据温度对平衡的影响来判断,升高温度平衡正向移动,
百分含量随温度的变化解答;根据温度对平衡的影响来判断,升高温度平衡正向移动,![]() 的含量增大,据此判断
的含量增大,据此判断![]() 大小,再由焓变和熵变判断反应自发进行的条件;
大小,再由焓变和熵变判断反应自发进行的条件;
Ⅱ在一定条件下,反应I达到最大反应限度时,说明反应达到化学平衡,各组分浓度不再改变,体系压强不再改变,正逆反应速率相等,据此逐项分析;根据反应Ⅰ和反应Ⅱ推导所求反应,由多重平衡规则计算该反应的化学平衡常数;
![]() 根据
根据![]() 计算
计算![]() 的消耗速率,根据转化率
的消耗速率,根据转化率![]() 计算
计算![]() 的平衡转化率
的平衡转化率![]() ;与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,实验c的压强大于实验a的压强;实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,N点达到化学平衡状态,再加入一定量
;与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,实验c的压强大于实验a的压强;实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,N点达到化学平衡状态,再加入一定量![]() ,促使化学平衡正向移动。
,促使化学平衡正向移动。
Ⅰ(1) ①固相和气相均存在的反应,固相的浓度项不列入化学平衡常数表达式,该反应的化学平衡常数表达式为: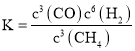 ;
;
故答案为: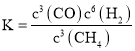 ;
;
![]() 在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入
在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入![]() ,
,![]() ,根据图中Ⅰ、Ⅱ、Ⅲ图象,温度逐渐升高,三个容器中的
,根据图中Ⅰ、Ⅱ、Ⅲ图象,温度逐渐升高,三个容器中的![]() 百分含量没有呈整体上升的趋势,则其中肯定有一个达到了平衡,温度升高,反应速率加快,可知先达到平衡的是容器III前两个容器没有达到平衡,且随温度升高,
百分含量没有呈整体上升的趋势,则其中肯定有一个达到了平衡,温度升高,反应速率加快,可知先达到平衡的是容器III前两个容器没有达到平衡,且随温度升高,![]() 百分含量下降,可知升高温度平衡正向进行,反应
百分含量下降,可知升高温度平衡正向进行,反应![]() 的
的![]() 大于0,反应气体分子数增多,熵增,即
大于0,反应气体分子数增多,熵增,即![]() ,反应放热,
,反应放热,![]() ,所以反应在高温下自发;
,所以反应在高温下自发;
故答案为:Ⅲ;大于;高温;
Ⅱ(1) ①单位时间内1mol![]() 消耗,必然同时有3mol
消耗,必然同时有3mol![]() 生成,说明反应正向进行,并不能说明反应已经达到化学平衡,故A错误;
生成,说明反应正向进行,并不能说明反应已经达到化学平衡,故A错误;![]() 、
、![]() 、CO的物质的量浓度关系取决于反应物的充入量以及反应进行的程度,并不能通过三者物质的量浓度相等说明反应达到化学平衡,故B错误;混合气体的密度为
、CO的物质的量浓度关系取决于反应物的充入量以及反应进行的程度,并不能通过三者物质的量浓度相等说明反应达到化学平衡,故B错误;混合气体的密度为![]() ,反应前后质量守恒,m不变,反应在恒容容器中进行,V不变,则整个过程混合气体密度
,反应前后质量守恒,m不变,反应在恒容容器中进行,V不变,则整个过程混合气体密度![]() 不变,无法判断化学反应是否达到化学平衡,故C错误;反应前后气体分子数改变,体系压强发生变化,可以通过压强判断化学反应是否达到平衡,故D正确;
不变,无法判断化学反应是否达到化学平衡,故C错误;反应前后气体分子数改变,体系压强发生变化,可以通过压强判断化学反应是否达到平衡,故D正确;
故答案为:D;
![]() 所求反应可由Ⅰ
所求反应可由Ⅰ![]() Ⅱ得到,根据多重平衡规则,所求反应的化学平衡常数为
Ⅱ得到,根据多重平衡规则,所求反应的化学平衡常数为![]() ;
;
故答案为:![]() ;
;
![]() 实验a中,起始时体系压强为320kPa,平衡时体系压强为240kPa,
实验a中,起始时体系压强为320kPa,平衡时体系压强为240kPa,
![]()
起始![]()
![]() 0
0
转化![]() x3x 2x
x3x 2x
平衡![]()
![]() 2x
2x
则有![]() ,可得
,可得![]() ,
,
所以实验a从开始至平衡时的反应速率![]() ,
,
实验c中![]() 的平衡转化率
的平衡转化率![]() 为
为![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,由此可判断实验b改变的条件是使用催化剂,
与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,由此可判断实验b改变的条件是使用催化剂,
实验c的压强大于实验a的压强,由此可判断实验c改变的条件是增大压强;
故答案为:使用催化剂;增大压强;
![]() 实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,所以M点的逆反应速率
实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,所以M点的逆反应速率![]() 点的正反应速率
点的正反应速率![]() ;N点达到化学平衡状态,再加入一定量
;N点达到化学平衡状态,再加入一定量![]() ,促使化学平衡正向移动,则平衡后
,促使化学平衡正向移动,则平衡后![]() 的体积分数增大;
的体积分数增大;
故答案为:![]() ;增大。
;增大。


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化。某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3。
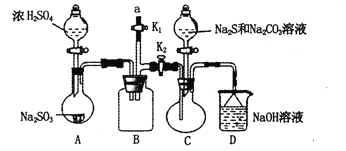
(1)实验开始的步骤,组装好仪器,____________,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(2)C中的烧瓶发生如下反应:2Na2S+ Na2CO3+4SO2=3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是________;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因_________。
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是__________。
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是____________。
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取。为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
①实验1、2的目的是探究_________对亚硫酸钠转化率的影响;
②若要完成上表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行____次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组模拟侯德榜制碱法制取Na2CO3的过程如下:

已知:①反应Ⅰ的化学方程式为:NH3+H2O+CO2=NH4HCO3
②滤液含NH4Cl等溶质
⑴反应Ⅱ为复分解反应,写出该反应的化学方程式______。
⑵验证滤液中含Cl-离子的实验方法和现象为______。
⑶反应Ⅲ的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一。SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
(1)氮氧化物破坏臭氧层原理为:①NO+O3![]() NO2+O2 ②NO2+O
NO2+O2 ②NO2+O![]() NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O
NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O![]() 2O2的平衡常数K =_______(用K1、K2表示)。氮氧化物在该反应中的作用是___________。
2O2的平衡常数K =_______(用K1、K2表示)。氮氧化物在该反应中的作用是___________。
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是________、________。
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。

①工业上选择催化剂乙的原因是______________;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率__________(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是(________)。
A.温度高于210oC,反应放热,平衡逆移
B.催化剂活性降低
C.温度高于210oC,发生了副反应
(4)二甲醚(CH3-O-CH3)代替氟利昂作为制冷剂可减少臭氧空洞。若用二甲醚-O2燃料电池作为电源,利用电解法制备纳米Cu2O,其装置如图所示。
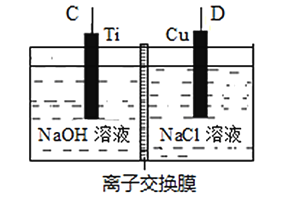
①上述装置中D电极应连接二甲醚燃料电池中通_______(填“CH3-O-CH3”或“O2”)的一极,该电解池中离子交换膜为_____离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:

(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为________________________________________________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是______________。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
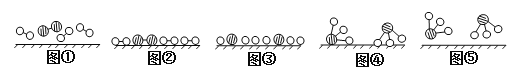
![]() 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是_____________________;在合成硝酸的吸收塔中通入空气的目的是______________________________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是________________________________。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)NO2(g)△H=+57kJmol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )
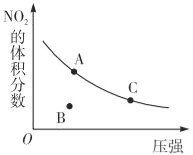
A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明![]() 溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
A.滴入酚酞溶液变红,再加入![]() 溶液红色褪去
溶液红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,在加入![]() 溶液后产生沉淀且红色褪去
溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___。保存“保险粉”时常加入少量Na2CO3固体,目的是___。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____。
(4)工业上可用如图装置电解NaHSO3和NaC1溶液制Na2S2O4。总反应为:2NaHSO3+2NaC1![]() Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____(填“正极”或“负极”),其电极反应式为____;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com