
| A. | 尿酸酸性比盐酸弱 | B. | 尿酸钠的溶解度随温度升高而增大 | ||
| C. | 反应①为吸热反应,②为放热反应 | D. | 尿酸钠的熔点很低 |
分析 由题目信息可知,关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,说明温度越低,越有利于尿酸钠的形成,降低温度平衡向放热方向移动;
A、尿酸存在电离平衡,尿酸是弱酸;
B、寒冷季节能诱发关节疼痛,说明有尿酸钠析出;
C、平衡①是弱电解质的电离,平衡②是形成化学键;
D、在寒冷季节能诱发关节疼痛,说明生成尿酸钠固体.
解答 解:A、尿酸存在电离平衡,尿酸是弱酸,而盐酸是强酸,所以尿酸酸性比盐酸弱,故A正确;
B、寒冷季节能诱发关节疼痛,说明有尿酸钠析出,所以尿酸钠的溶解度随温度升高而增大,故B正确;
C、弱电解质的电离是吸热过程,而形成化学键是放热的过程,故C正确;
D、在寒冷季节能诱发关节疼痛,说明生成尿酸钠固体,说明尿酸钠熔点高,故D错误;
故选D.
点评 本题考查化学平衡的影响因素,以关节炎的病因为载体,考查学生运用知识分析解决问题的能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向左移动 | |
| B. | 加入少量CH3COONa固体,平衡向右移动 | |
| C. | 加入少量NaOH固体,平衡向右移动 | |
| D. | 加入少量0.01mol•L-1HCl溶液,溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸缓慢地沿着量筒内壁倒入蒸馏水中,并用玻璃棒进行搅拌 | |
| B. | 实验室的酒精灯着火时,应该立即往上撒水 | |
| C. | 实验室制氧气,组装好装置后,应该先检查装置的气密性 | |
| D. | 过滤时,若滤液浑浊,则将滤液放入蒸发皿中进行蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发浓缩 | B. | 加CuCl2固体 | C. | 加入AgNO3 | D. | 加入食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
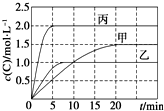 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.
三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com