
【题目】CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) ![]() CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:
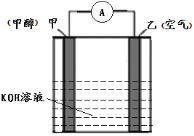
①该原电池的正极是____(填“甲”或“乙”),电解过程中乙电极附近pH____(填“增大”或“减小”);
②负极的电极反应式________________________________。
【答案】 0.04mol/(L min) cd bd 乙 增大 CH3OH+8OH--6e-![]() CO32-+6H2O
CO32-+6H2O
【解析】分析: (1)根据v=![]() 计算 v(CH4),根据速率之比等于化学计量数之比换算v(H2O)。
计算 v(CH4),根据速率之比等于化学计量数之比换算v(H2O)。
(2) 升高温度、增大反应物浓度、使用催化剂等能加快反应速率;
(3) 正反应速率等于逆反应速率,混合物中各组分浓度保持不变则达到平衡状态,以此分析;
(4)甲醇燃料电池中,负极上燃料甲醇失电子发生氧化反应,正极上氧化剂得电子发生还原反应,据此判断电极名称并书写电极反应式,根据电极反应分析电极附近溶液pH变化。
(1)0~5 min内,v(H2O)=v(CH4)=![]() =0.04 mol/(L·min)。
=0.04 mol/(L·min)。
故答案为:0.04mol/(L min);
(2) a.恒容条件下加He,体系压强增大但反应物浓度不变,化学反应速率不变;b.增大体积,反应物浓度减小,化学反应速率减小;c.升高温度能加快反应速率;d.投入更多的H2O(g),增大反应物浓度,反应速率加快;
故答案为:cd;
(3) a项,均表示正反应,故a错误;b项,该反应是反应前后气体分子数发生变化的反应,容器内压强保持不变,说明各物质浓度保持不变,说明已达平衡,故b正确;c项,因为反应物、生成物全是气体,且为恒容容器,混合气体的密度始终不变,故c错误;d.当CH3OH(g)的浓度保持不变时,说明反应达到了平衡状态,正确,
故答案为:bd;
(4) ①氧气在乙电极发生还原反应,故乙电极是正极,该原电池的正极是乙;正极为氧气得电子生成氢氧根离子,所以电解过程中乙电极附近pH增大;
故答案为:乙 ;增大;
②可燃物甲醇在负极失去电子消耗OH-生成CO32-,所以负极电极反应式为:CH3OH+8OH--6e-![]() CO32-+6H2O
CO32-+6H2O
因此,本题正确答案是:CH3OH+8OH--6e-![]() CO32-+6H2O。
CO32-+6H2O。


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质的溶液混合后,再加足量的稀硝酸,仍有沉淀存在的是
A.K2CO3、BaCl2B.NaOH、CuSO4
C.AgNO3、NaClD.Na2CO3、CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义.该原子的中子数与质子数之差是( )
A.175
B.114
C.61
D.289
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 HbCO,使血红蛋白 失去输送 O2 功能.CO 进入血液后有如下平衡:CO+HbO2O2+HbCO,已知在人体体温37℃下,该平衡常数为 220.试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以 说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10﹣6mol/L,c(O )=10﹣2mol/L,则 c(HbCO)为 c(HbO2)的倍.
(3)已知当血液中 c(HbCO)的比值大于 0.02 时,人的智力会很快受到损伤,为避免c(HbO2 )
人的智力受到损伤,c(O2)与 c(CO)的比值应大于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.2g H2含有的氢原子数目为NA
B.常温常压下,22.4L O2含有的分子数目为NA
C.1L 1molL﹣1 KOH溶液中含有的钾离子数目为NA
D.1mol Zn变为Zn2+时失去的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。
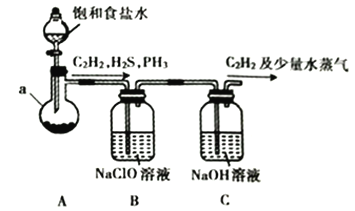
①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。
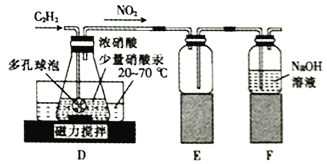
①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A.反应①的平衡常数K1= ![]()
B.反应③的平衡常数K= ![]()
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:
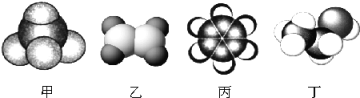
(1)丁的结构简式是_____________。
(2)上述物质中,丙是种无色带有特殊气味的有毒液体,且不溶于水,密度比水小。向其中加入溴水,振荡静置后,观察到的现象是______________。
(3)写出在一定条件下,乙发生聚合反应生成高分于化合物的化学方程式________。
(4)与甲互为同系物的物质均符合通式CnH2n+2,当n=6时,该有机物有___种同分异构体,其中碳链最短的同分异构体的结构简式是________________、__________。
(5)用甲作燃料的碱性燃料电池中,电极材料为多孔情性金属电极,则负极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为___________,其核外共有_____种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是_______________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为_________________(用元素符号表示),SeO2分子的空间构型为___________________。
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__________,每个P4S3分子中含孤电子对的数目为_______________。

(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为________g·cm-3。(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com