
室温下,现有A、B、C、D、E、F六种常见化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1 mol/L的溶液,进行如下实验:(已知:室温下,饱和氢氧化钙溶液浓度约为0.00165 g/mL)
①测得溶液A、C、E呈碱性,且碱性为A > E > C;
②向B溶液中滴加Na2S溶液,出现难溶于强酸且阴阳离子个数比为1∶2的黑色沉淀;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A _____________、B _____________、C _____________。
(2)实验④中白色沉淀变为红褐色对应的化学方程式:_______________________
(3)D与E的溶液反应离子方程式是:__________________________________。
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.往澄清石灰水中通入过量的CO2:OH-+CO2=HCO3-
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3+ + 3H2↑
C.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
D.小苏打与醋酸反应:HCO3-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
① CO(g) + 2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
② CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2
CH3OH(g)+ H2O(g) △H2
③ CO2(g) + H2(g) CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
则△H1= kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为 (填曲线标记字母),判断理由是 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”)原因是 。
图2中的压强由大到小为 ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:选择题
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
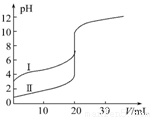
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:填空题
在一定温度下,发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 64.0 | 50.7 | 42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH_____0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率为 。
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正 v逆(填“<”、“>”或“=”),平衡向 移动(填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:填空题
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
①写出该反应的化学平衡常数表达式:K= .随着温度的升高,K值 。(填增大、减小、不变).
②平衡常数K值越大,表明 (填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)= 0.10/t1 mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com