
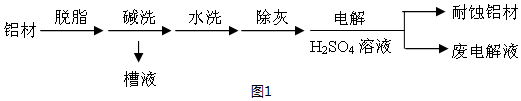
分析 (1)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
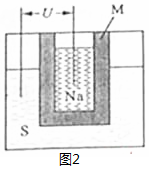
(2)①原电池正极发生得电子的还原反应,结合原电池的构成条件和题意实际情况来分析M的作用,根据铅蓄电池的工作原理和钠硫高能电池的工作原理来回答;
②根据盐的电离和离子的水解知识来比较离子浓度大小,根据加入硫酸铜后所发生的反应情况来判断pH的变化,根据硫离子的强还原性来回答.
解答 解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;因为Al3+和HCO3-发生了双水解,Al3++3HCO3-═Al(OH)3↓+CO2↑;
(2)①原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx),M作为电解质的同时又将钠和硫隔开,与铅蓄电池相比,当消耗相同质量的负极活性物质铅和钠时,铅成为铅离子时转移电子的物质的量是钠成为钠离子时转移的电子的物质的量的4.5倍,即钠硫电池的理论放电量是铅蓄电池4.5倍,故答案为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx)、离子导电(导电或电解质)和隔离钠与硫、4.5;
②硫化钠电离出的离子有钠离子和硫离子,理论上钠离子浓度是硫离子的2倍,故c(Na+)>c(S2-),但少量的硫离子水解,第一步水解强于第二步,两步水解均生成氢氧根,故c(S2-)>c(OH-)>c(HS-),溶液显碱性,故氢离子浓度最小,加硫酸铜后,溶液由碱性硫化钠溶液变为中性硫酸钠溶液,故pH 减小,
硫离子有很强还原性,很容易被空气氧化,反应方程式为:2S2-+O2+2H2O=2S↓+4OH-,
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;2S2-+O2+2H2O=2S↓+4OH-.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应及混合物分离方法为解答的关键,注意氧化还原反应、电化学反应原理的应用,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NA个氢分子与NA个氧分子的质量比为1:1 | |
| B. | 1 mol氢气的质量与NA个氢分子的质量相等 | |
| C. | 16g氧气中含有的氧原子数为NA | |
| D. | 44g CO2与28g CO所含有的分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4 (CuSO4):加足量铁粉后,过滤 | |
| B. | CO (CO2):用NaOH溶液洗气后干燥 | |
| C. | CO2 (HCl):用NaOH溶液洗气后干燥 | |
| D. | MnO2 (KCl):加水溶解后,过滤、洗涤、烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯碱 | 冰水混合物 | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 乙醇 |
| C | 明矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | 氨水 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 | B. | NaOH | C. | FeCl2 | D. | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯化氢和22.4升氮气 | |
| B. | 2molCO2和3molH2 | |
| C. | 在标准状况下16gO2和16gCH4 | |
| D. | 同温同压下,0.5mol氨气和14克CO气体 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
如下图两个电解槽中,a、b、c、d均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )

A.甲烧杯中a极上最多可析出铜0.64g
B.甲烧杯中b极上电极反应式4OH--4e-= 2H2O+O2↑
C.乙烧杯中滴入酚酞试液,d极附近先变红
D.烧杯中c极上电极反应式为4H+ + 4e-=2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②⑤⑥ | C. | ③⑤ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com