

分析 对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重,则说明③电极上银离子得电子析出银,则③是电解池阴极,所以④②是阳极,①是阴极,原电池中E是负极,F是正极,原电池负极上甲醇失电子发生氧化反应,电解池阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
解答 解:(1)对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重,则说明③电极上银离子得电子析出银,则③是电解池阴极,所以④②是阳极,①是阴极,原电池中E是负极,F是正极,故答案为:正极;阳极;
(2)电解池中,③上银离子得电子生成银单质,④电极上银失电子生成银离子进入溶液,电极反应式为:Ag-e-=Ag+,E是原电池负极,负极上甲醇失电子和氢氧根离子生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,A装置中,①是阴极,该电极上先是铜离子得电子而析出,后氢离子得电子析出氢气,
故答案为:Ag-e-=Ag+;CH3OH+8OH--6e-═CO32-+6H2O;
(3)设1.6g甲醇反应转移电子的物质的量是x,
CH3OH+8OH--6e-═CO32-+6H2O
32g 6mol
1.6g x
x=$\frac{1.6g×6mol}{32g}$=0.3mol
③上银离子得电子生成银单质,根据电子守恒,转移0.3mol电子析出金属银是0.3mol,银的质量为:0.3mol×108g/mol=32.4g,
故答案为:32.4.
点评 本题考查了原电池和电解池工作原理,根据银离子在阴极上得到电子发生还原反应使阴极增重判断电极是解题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质的组成元素是否单一,将纯净物分为单质和化合物 | |
| B. | 根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 | |
| C. | 根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| D. | 根据变化过程中是否有化学键的断裂,将物质变化分为物理变化和化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
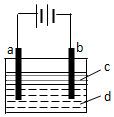 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL | |
| C. | 0.270 kg质量分数为10%的CuCl2溶液中Cl-的物质的量为0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
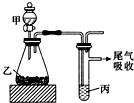
| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:H2O>C2H2>Br2 |
| B | 盐酸 | 硫化亚铁 | 溴水 | 还原性:Cl->Br->S2- |
| C | 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性:高锰酸钾>Cl2>Br2 |
| D | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com