
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是
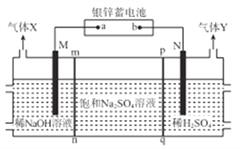
A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
【答案】D
【解析】用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,根据装置图可知,该电解池的左侧为NaOH溶液,右侧为H2SO4溶液,说明M电极为阴极,水电离的H+在M电极上得电子生成H2,电极反应式为:2H2O+2e-=H2↑+2OH-,中间隔室的Na+通过mn膜进入装置左侧区域与生成的OH-结合生成NaOH,N电极为阳极,水电离的OH-在N电极上失电子生成O2,电极反应式为:2H2O-4e-=O2↑+4H+,中间隔室的SO42-通过pq膜进入装置右侧区域与生成的H+结合生成H2SO4。A. 根据上述分析可知,M为阴极,则a为负极、b为正极,a电极的反应式为Zn-2e-+2OH-=Zn(OH)2,故A错误;B. N电极的反应式为2H2O-4e-=O2↑+4H+,气体Y为O2,故B错误;C. 因中间隔室的SO42-通过pq膜进入装置右侧区域与生成的H+结合生成H2SO4,则pq膜应选择阴离子交换膜,故C错误;D. 65gZn的物质的量为1mol,当消耗65gZn时,转移电子的物质的量为2mol,M电极的反应式为2H2O+2e-=H2↑+2OH-,由反应式可知,当转移2mol电子时,生成H2的物质的量为1mol,故D正确;答案选D。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)外观为有光泽的晶体。其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是
A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氧代物1种、二氯代物有3种、三氯代物也有3种
C. 立方烷是苯(C6H6)的同系物、也是苯乙烯(C6H5-CH=CH2)的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种元素的离子半径大小顺序是( )
A.A>B>CB.B>A>CC.C>A>BD.C>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
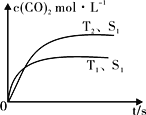
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:
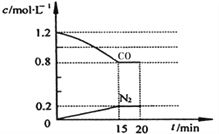
①有害气体NO的转化率为________, 0~15min NO的平均速率v(NO)=______mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子①F- ②Na+ ③HF ④NH3⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组对碳与浓硝酸的反应进行探究,已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O。请回答下列可题:
I.甲同学设计 如图所示装置制备并收集NO
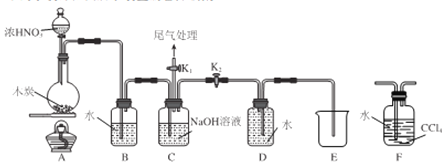
(1)碳与浓硝酸反应的化学方程式为__________________。
(2)C的作用为_______________。
(3)乙同学认为用装置F代替B更合理,理由为_______________。
(4)乙同学用改进后的装置进行实验。
①将浓HNO3滴入圆底烧瓶中的操作为__________________。
②点燃A处酒精灯开始反应后,圆底烧瓶中的现象为________________。
II.探究NO与Na2O2反应
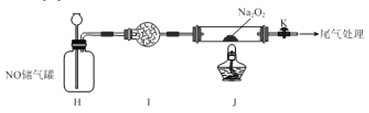
已知NaNO2既有氧化性,又有还原性;J 处硬质玻璃管中制得的NaNO2中含有少量NaNO3。
(5)检验上图装置气密性的方法为____________________。
(6)实验结束后,设计实验证明J 处硬质玻璃管中有NaNO2生成________________。
供选试剂:蒸馏水KI-淀粉溶液,KMnO4溶液、NaOH溶液.BaCl2溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )
A. 加入适量的6mol/L的硫酸 B. 适当加热
C. 加入适量蒸馏水 D. 加入适量的稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com