

| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
分析 A.由图象分析,2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量;
B.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量;
C.H2O(g)生成H2O(l)属于物理变化;
D.由图象分析,2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1.
解答 解:A.由图象分析,2mol H2(g)与1mol O2(g)反应生成2mol H2O(g),放出483.6kJ的热量,故2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高,故A错误;
B.氢气的燃烧热是指1mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为△H=-$\frac{483.6+88}{2}$=-285.8kJ•mol-1,故B错误;
C.H2O(g)生成H2O(l)为物理变化,不存在化学键的断裂和生成,故C错误;
D.由图象分析,2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ•mol-1,所以液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1,故D正确;
故选D.
点评 本题综合考查化学反应与能量变化知识,侧重于学生的分析能力和计算能力的考查,注意把握燃烧热的定义以及盖斯定律的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,所有元素的化合价都发生变化 | |
| B. | 氧化还原反应前后一定存在氧的得失 | |
| C. | 置换反应一定属于氧化还原反应 | |
| D. | 化合反应和分解反应不可能是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
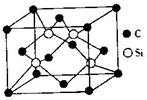 氮化硅是一种重要的结构陶瓷材料,具有优良性能.
氮化硅是一种重要的结构陶瓷材料,具有优良性能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )| A. | 点o溶液、点b溶液、点d溶液的pH都大于7 | |
| B. | 点b溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) | |
| C. | 点o溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) | |
| D. | 点a溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维和计算机芯片的材料都是二氧化硅 | |
| B. | 蛋白质只含C、H、O、N四种元素 | |
| C. | 可用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| D. | 液溴易挥发,在存放液溴的试剂瓶中应加水“液封” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
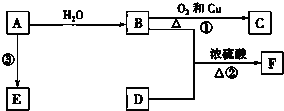 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.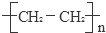 ,反应类型:加聚反应.
,反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com