
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 _________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图B,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
【答案】 Zn+2H+===Zn2++H2↑ 正 2H++2e-===H2↑ 6.5 a CH4+10OH--8e-===CO32-+7H2O 减小
【解析】试题分析:(1)①a和b不连接时,不能构成原电池;②a和b用导线连接构成原电池,锌比铜活泼,Cu为正极、锌为负极;③根据![]() 分析;(2)①电池的负极失电子发生氧化反应,正极得电子发生还原反应; ②根据电池总反应分析电池工作一段时间后电解质溶液的pH;
分析;(2)①电池的负极失电子发生氧化反应,正极得电子发生还原反应; ②根据电池总反应分析电池工作一段时间后电解质溶液的pH;
解析:(1)①a和b不连接时,不能构成原电池,锌与硫酸发生反应生成硫酸锌和氢气,离子方程式是Zn+2H+===Zn2++H2↑;②a和b用导线连接构成原电池,锌比铜活泼,Cu为正极、锌为负极,正极电极反应式是2H++2e-===H2↑,负极反应式为![]() ;③根据
;③根据![]() ,转移了0.2 mol电子,消耗0.1molZn,质量为0.1mol×65g/mol=6.5g;(2)①负极失电子发生氧化反应,正极得电子发生还原反应,a极通入甲烷,甲烷发生氧化反应,故a是负极,负极电极反应为CH4+10OH--8e-===CO32-+7H2O; ②电池总反应为CH4+2O2+2OH-===CO32-+3H2O,,电池工作时消耗氢氧根离子,电解质溶液的pH减小。
,转移了0.2 mol电子,消耗0.1molZn,质量为0.1mol×65g/mol=6.5g;(2)①负极失电子发生氧化反应,正极得电子发生还原反应,a极通入甲烷,甲烷发生氧化反应,故a是负极,负极电极反应为CH4+10OH--8e-===CO32-+7H2O; ②电池总反应为CH4+2O2+2OH-===CO32-+3H2O,,电池工作时消耗氢氧根离子,电解质溶液的pH减小。


科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L﹣1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A.该混合溶液pH=7.0
B.原HA溶液中:c(HA)>c(H+)>c(A﹣)
C.图中X表示HA,Y表示OH﹣,Z表示H+
D.混合溶液中:c(X)+x(A﹣)=c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A. 常温下电离常数为Ka的酸HA溶液中c(H+)![]() mol·L-1
mol·L-1
B. 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
C. 0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合
2c(H+)-2 c(OH-)=c(CH3COO-)- c(CH3COOH)
D. 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二酯(J)具有良好的力学性能,其薄膜的伸拉强度是聚乙烯薄膜的9倍。它的合成路线如下:
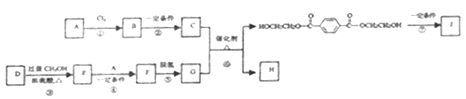
已知:
①![]()
②酯与醇可发生如下酯交换反应:RCOOR′+R〞OH ![]() RCOOR〞+R′OH(R、R′、R〞代表烃基)
RCOOR〞+R′OH(R、R′、R〞代表烃基)
(1)A的产量标志着一个国家石油化工发展水平,反应①的反应类型为______________。
(2)C的分子式是C2H6O2,是汽车防冻液的主要成分。反应②的试剂和反应条件是____________。
(3)D的分子式是C6H6O4,是一种直链结构的分子,核磁共振氢谱有3种峰,D种含有的官能团是______。
(4)F的结构简式是__________________。
(5)反应⑥的化学方程式是_________________。
(6)反应⑦为缩聚反应,反应⑦的化学方程式是_________________。
(7)G是一种同分异构体,G′为甲酸酯,核磁共振氢谱有3种峰且1mol该有机物酸性条件下水解产物能与2molNaOH反应。G′的结构简式为______________。
(8)以对二甲苯、甲醇为起始原料,选用必要的无机试剂合成G,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质属于同位素的是___________,属于同分异构体的是_________,属于同一物质的是__________。
(1)O2和O3
(2)3517Cl和3717Cl
(3)CH3CH3和CH3CH2CH2CH3
(4)金刚石和石墨
(5)氕、氘、氚
(6)CH3CH2CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
(7)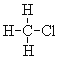 和
和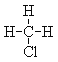
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
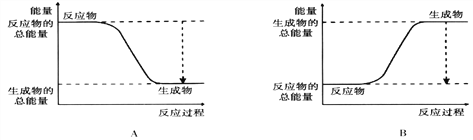
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL浓度均为0.10molL-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是

A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,8gO2含有16NA个电子
B. 1 molL-1MgCl2溶液中含有氯离子个数为2NA
C. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
D. 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com