
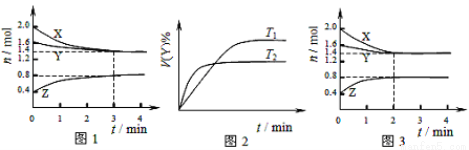
T ”ꏱŌŚ2LČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠŹ¹X(g)ÓėY(g)·¢Éś·“Ӧɜ³ÉZ(g)”£·“Ó¦¹ż³ĢÖŠX”¢Y”¢Z µÄÅØ¶Č±ä»ÆČēĶ¼1ĖłŹ¾£»Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĪĀ¶Č·Ö±šĪŖT1ŗĶT2Ź±£¬YµÄĢå»ż°Ł·Öŗ¬ĮæÓėŹ±¼äµÄ¹ŲĻµČēĶ¼2ĖłŹ¾”£ŌņĻĀĮŠ½įĀŪ“ķĪóµÄŹĒ£Ø £©
A£®ČŻĘ÷ÖŠ·¢ÉśµÄ·“Ó¦æɱķŹ¾ĪŖ£ŗ3X(g)+Y(g)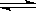 2Z(g)
2Z(g)
B£®Ķ¼1 ·“Ó¦½ųŠŠĒ°3minÄŚ£¬ÓĆX±ķŹ¾µÄ·“Ó¦ĖŁĀŹv(X)£½0.1mol/(L”¤min)
C£®Čōøı䷓ӦĢõ¼ž£¬Ź¹·“Ó¦½ų³ĢČēĶ¼3ĖłŹ¾£¬ŌņøıäµÄĢõ¼žŹĒŹ¹ÓĆ“ß»Æ¼Į
D£®±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬»ÆŃ§Ę½ŗāĻņÄę·“Ó¦·½ĻņŅʶÆ
D
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA. øł¾ŻĶ¼1æÉÖŖŌŚĻąĶ¬µÄŹ±¼äÄŚX¼õŠ”0.6£¬Y¼ĘĖć0.2£¬ZŌö¼Ó0.4£¬×īÖÕø÷ÖÖĪļÖŹµÄÅØ¶Č¶¼²»ŌŁ·¢Éś±ä»Æ£¬ĖłŅŌøĆ·“Ó¦ŹĒæÉÄę·“Ó¦£¬ČŻĘ÷ÖŠ·¢ÉśµÄ·“Ó¦æɱķŹ¾ĪŖ£ŗ3X(g)+Y(g) 
 2Z(g)£¬ÕżČ·£»B£®Ķ¼1 ·“Ó¦½ųŠŠĒ°3minÄŚ£¬ÓĆX±ķŹ¾µÄ·“Ó¦ĖŁĀŹv(X)£½(0.6mol”Ā2L)”Ā3min=0.1mol/(L”¤min)£¬ÕżČ·£»C.ÓÉÓŚøı䷓ӦĢõ¼žŗó·“Ó¦ĖŁĀŹ¼Óæģ£¬Ėõ¶ĢĮĖ“ļµ½Ę½ŗāĖłŠčŅŖµÄŹ±¼ä£¬µ«ŹĒĪļÖŹµÄĘ½ŗāŗ¬Įæ²»±ä£¬ŌņøıäµÄĢõ¼žŹĒŹ¹ÓĆ“ß»Æ¼Į£¬ÕżČ·£»D£®øł¾ŻĶ¼2æÉÖŖŌŚĪĀ¶ČĪŖT2Ź±Ź×ĻČ“ļµ½ÅŠ¶Ļ£¬ŌņÓÉÓŚÉżøßĪĀ¶Č£¬»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ£¬ĖłŅŌT2>T1£¬µ«ŹĒÉżøßĪĀ¶ČŗóYµÄĘ½ŗāŗ¬Įæ½µµĶ£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬øł¾ŻĘ½ŗāŅʶÆŌĄķ£ŗÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬“ķĪó”£
2Z(g)£¬ÕżČ·£»B£®Ķ¼1 ·“Ó¦½ųŠŠĒ°3minÄŚ£¬ÓĆX±ķŹ¾µÄ·“Ó¦ĖŁĀŹv(X)£½(0.6mol”Ā2L)”Ā3min=0.1mol/(L”¤min)£¬ÕżČ·£»C.ÓÉÓŚøı䷓ӦĢõ¼žŗó·“Ó¦ĖŁĀŹ¼Óæģ£¬Ėõ¶ĢĮĖ“ļµ½Ę½ŗāĖłŠčŅŖµÄŹ±¼ä£¬µ«ŹĒĪļÖŹµÄĘ½ŗāŗ¬Įæ²»±ä£¬ŌņøıäµÄĢõ¼žŹĒŹ¹ÓĆ“ß»Æ¼Į£¬ÕżČ·£»D£®øł¾ŻĶ¼2æÉÖŖŌŚĪĀ¶ČĪŖT2Ź±Ź×ĻČ“ļµ½ÅŠ¶Ļ£¬ŌņÓÉÓŚÉżøßĪĀ¶Č£¬»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ£¬ĖłŅŌT2>T1£¬µ«ŹĒÉżøßĪĀ¶ČŗóYµÄĘ½ŗāŗ¬Įæ½µµĶ£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬øł¾ŻĘ½ŗāŅʶÆŌĄķ£ŗÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬“ķĪó”£
æ¼µć£ŗæ¼²é»Æѧ·½³ĢŹ½µÄČ·¶Ø”¢ĪĀ¶Č”¢“߻ƼĮ¶Ō»ÆŃ§Ę½ŗāŅĘ¶ÆµÄÓ°ĻģµÄÖŖŹ¶”£


 ŠĀĖ¼Ī¬¼ŁĘŚ×÷ŅµŹī¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŠĀĖ¼Ī¬¼ŁĘŚ×÷ŅµŹī¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø Ą¶Ģģ½ĢÓżŹī¼ŁÓÅ»ÆѧĻ°ĻµĮŠ“š°ø
Ą¶Ģģ½ĢÓżŹī¼ŁÓÅ»ÆѧĻ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014”«2015ѧğ½Ī÷øÓÖŻøÓĻŲ֊ѧ±±Š£Ēųø߶ž9ŌĀŌĀæ¼B²ć»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
£Ø10·Ö£©Ä³ŹµŃ銔×éÓĆ0£®50 mol”¤L-1NaOHČÜŅŗŗĶ0£®50 mol”¤L-1ĮņĖįČÜŅŗ½ųŠŠÖŠŗĶČČµÄ²ā¶Ø”£
¢ń£®ÅäÖĘ0£®50 mol”¤L-1NaOHČÜŅŗ
£Ø1£©ČōŹµŃéÖŠ“óŌ¼ŅŖŹ¹ÓĆ470 mL NaOHČÜŅŗ,ÖĮÉŁŠčŅŖ³ĘĮæNaOH¹ĢĢå g”£
£Ø2£©“ÓĶ¼ÖŠŃ”Ōń³ĘĮæNaOH¹ĢĢåĖłŠčŅŖµÄŅĒĘ÷ŹĒ(Ģī×ÖÄø): ”£
Ćū³Ę | ĶŠÅĢĢģĘ½ | Š”ÉÕ± | ŪįŪöĒÆ | ²£Į§°ō | Ņ©³× | ĮæĶ² |
ŅĒĘ÷ |
|
|
|
|
|
|
ŠņŗÅ | a | b | c | d | e | f |
¢ņ£®²ā¶ØÖŠŗĶČČ£ŗ£Ø1£©ŹµŃéץÉĻ±øÓŠÉÕ±(“󔢊”Į½øöÉÕ±)”¢ÅŻÄĖÜĮĻ”¢ÅŻÄĖÜĮĻ°å”¢½ŗĶ·µĪ¹Ü”¢ĮæĶ²”¢ŃĪĖį”¢NaOHČÜŅŗ,ɊȱɣµÄŹµŃé²£Į§ÓĆĘ·ŹĒ ”£
£Ø2£©Č”50 mL NaOHČÜŅŗŗĶ30 mLĮņĖįČÜŅŗ½ųŠŠŹµŃé,ŹµŃ鏿¾ŻČēĻĀ±ķ”£¢ŁĒėĢīŠ“ĻĀ±ķÖŠµÄæÕ°×:
ŹµŃé “ĪŹż | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ¶Č t2/”ę | ĪĀ¶Č²īĘ½¾łÖµ (t2-t1)/”ę | ||
H2SO4 | NaOH | Ę½¾łÖµ | |||
1 | 26£®2 | 26£®0 | 26£®1 | 30£®1 |
|
2 | 27£®0 | 27£®4 | 27£®2 | 33£®3 | |
3 | 25£®9 | 25£®9 | 25£®9 | 29£®8 | |
4 | 26£®4 | 26£®2 | 26£®3 | 30£®4 | |
¢Ś½üĖĘČĻĪŖ0£®50 mol”¤L-1NaOHČÜŅŗŗĶ0£®50 mol/LĮņĖįČÜŅŗµÄĆܶȶ¼ŹĒ1 g/cm3,ÖŠŗĶŗóÉś³ÉČÜŅŗµÄ±ČČČČŻc=”°4£®18”±J/(g”¤”ę)”£ŌņÖŠŗĶČȦ¤H= (Č”Š”ŹżµćŗóŅ»Ī»)”£
¢ŪÉĻŹöŹµŃ鏿ֵ½į¹ūÓė57£®3 kJ”¤mol-1ÓŠĘ«²ī,²śÉśĘ«²īµÄŌŅņæÉÄÜŹĒ(Ģī×ÖÄø) ”£
A£®ŹµŃé×°ÖƱ£ĪĀ”¢øōČČŠ§¹ū²ī B£®ĮæČ”NaOHČÜŅŗµÄĢå»żŹ±ŃöŹÓ¶ĮŹż
C£®·Ö¶ą“Ī°ŃNaOHČÜŅŗµ¹ČėŹ¢ÓŠĮņĖįµÄŠ”ÉÕ±ÖŠ
D£®ÓĆĪĀ¶Č¼Ę²ā¶ØNaOHČÜŅŗĘšŹ¼ĪĀ¶ČŗóÖ±½Ó²ā¶ØH2SO4ČÜŅŗµÄĪĀ¶Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014”«2015ѧğ½Ī÷øÓÖŻøÓĻŲ֊ѧ±±Š£Ēųø߶ž9ŌĀŌĀæ¼A²ć»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹ŲÓŚĻĀĮŠ¹ż³ĢģŲ±äµÄÅŠ¶Ļ²»ÕżČ·µÄŹĒ£Ø””””£©
A£®ČܽāÉŁĮæŹ³ŃĪÓŚĖ®ÖŠ£¬ B£®“æĢ¼ŗĶŃõĘų·“Ӧɜ³É
B£®“æĢ¼ŗĶŃõĘų·“Ӧɜ³É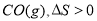
C£®H2O(g)±ä³ÉŅŗĢ¬Ė®£¬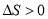 D£®CaCO3(s)¼ÓČČ·Ö½āĪŖCaOŗĶCO2(g)£¬
D£®CaCO3(s)¼ÓČČ·Ö½āĪŖCaOŗĶCO2(g)£¬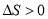
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014”«2015ѧğ½Ī÷øÓÖŻøÓĻŲ֊ѧ±±Š£ĒųøßŅ»9ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓĆæÉČÜŠŌ±µŃĪ¼ģŃéSO42-Ąė×ӵēęŌŚŹ±£¬ĻČŌŚ“ż²āČÜŅŗÖŠ¼ÓČėŃĪĖį£¬Ęä×÷ÓĆŹĒ ( )
A£®ŠĪ³É½Ļ¶ąµÄ°×É«³Įµķ B£®ÅųżSO42-ŅŌĶāµÄĘäĖüŅõĄė×Ó¼°Ag+µÄøÉČÅ
C£®ŠĪ³ÉµÄ³Įµķ“æ¶Čøüøß D£®ÅųżBa2+ŅŌĶāµÄĘäĖüŃōĄė×ÓµÄøÉČÅ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014”«2015ѧğ½Ī÷ĖÄŠ£9ŌĀĮŖæ¼ø߶ž»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø10·Ö£© ”°µĶĢ¼Ń»·”±ŅżĘšø÷¹śµÄø߶ČÖŲŹÓ£¬ŅŃÖŖĆŗ”¢¼×ĶéµČæÉŅŌÓėĖ®ÕōĘų·“Ӧɜ³ÉŅŌCOŗĶH2ĪŖÖ÷µÄŗĻ³ÉĘų£¬ŗĻ³ÉĘųÓŠ¹ć·ŗÓ¦ÓĆ”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øßĀÆĮ¶ĢśŹĒCOĘųĢåµÄÖŲŅŖÓĆĶ¾Ö®Ņ»£¬Ę仳±¾·“Ó¦ĪŖ£ŗFeO(s)£«CO(g) Fe(s)£«CO2(g) ¦¤H£¾0”£ŅŃÖŖŌŚ1 100 ”ꏱ£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK=0.263”£
Fe(s)£«CO2(g) ¦¤H£¾0”£ŅŃÖŖŌŚ1 100 ”ꏱ£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK=0.263”£
¢ŁĪĀ¶ČÉżøߣ¬»ÆŃ§Ę½ŗāŅʶÆŗó“ļµ½ŠĀµÄĘ½ŗā£¬“ĖŹ±Ę½ŗā³£ŹżKÖµ (Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£»
¢Ś1 100 ”ꏱ²āµĆøßĀÆÖŠ£¬c(CO2)=0.025 mol”¤L-1£¬c(CO)=0.1 mol”¤L-1£¬ŌņŌŚÕāÖÖĒéæöĻĀ£¬øĆ·“Ó¦Ļņ ½ųŠŠ(Ģī”°×ó”±»ņ”°ÓŅ”±)£¬ÅŠ¶ĻŅĄ¾ŻŹĒ ”£
£Ø2£©ÄæĒ°¹¤ŅµÉĻŅ²æÉÓĆCO2Ą“Éś²śČ¼ĮĻ¼×“¼£¬ÓŠ¹Ų·“Ó¦ĪŖ£ŗ
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ¦¤H=£49.0KJ/mol£¬ĻÖĻņĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ³äČė1mol CO2ŗĶ3molH2£¬·“Ó¦¹ż³ĢÖŠ²āµĆCO2ŗĶCH3OH£Øg£©µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
CH3OH(g)+H2O(g) ¦¤H=£49.0KJ/mol£¬ĻÖĻņĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ³äČė1mol CO2ŗĶ3molH2£¬·“Ó¦¹ż³ĢÖŠ²āµĆCO2ŗĶCH3OH£Øg£©µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
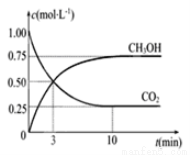
¢Ł“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ĒāĘųµÄĘ½¾ł·“Ó¦ĖŁĀŹV£ØH2£©=------------”£
¢Ś·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻĀĮŠ“ėŹ©ÄÜŹ¹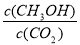 Ōö“óµÄŹĒ-------£ØĢī·ūŗÅ£©
Ōö“óµÄŹĒ-------£ØĢī·ūŗÅ£©
A£®ÉżøßĪĀ¶Č B£®ŌŁ³äČėH2 C£®ŌŁ³äČėCO2 D£®½«H2O£Øg£©“ÓĢåĻµÖŠ·ÖĄė E£®³äČėHe£Øg£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014”«2015ѧğ½Ī÷ĖÄŠ£9ŌĀĮŖæ¼ø߶ž»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĒæĖįŗĶĒæ¼īµÄĻ”ČÜŅŗµÄÖŠŗĶČČæɱķŹ¾ĪŖ£ŗH+(aq)+OH-(aq)=H2O(l) ¦¤H=£57.3KJ/mol
ŅŃÖŖCH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ¦¤H=£Q1KJ/mol
1/2H2SO4(ÅØ)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ¦¤H=£Q2KJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ¦¤H=£Q3KJ/mol
ÉĻŹö·“Ó¦¾łĪŖČÜŅŗÖŠµÄ·“Ó¦£¬ŌņQ1”¢Q2”¢Q3µÄ¾ų¶ŌÖµ“󊔵ĹŲĻµĪŖ£Ø £©
A£®Q1=Q2=Q3 B£®Q2>Q1>Q3 C£®Q2>Q3>Q1 D£®Q2=Q3>Q1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014”«2015ѧğ½Ī÷ĖÄŠ£9ŌĀĮŖæ¼ø߶ž»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
A£®¦¤H<0”¢¦¤S>0µÄ·“Ó¦ŌŚČĪŗĪĪĀ¶ČĻĀ¶¼ÄÜ×Ō·¢½ųŠŠ
B£®NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g)””¦¤H=+185.57 kJ”¤mol-1ÄÜ×Ō·¢½ųŠŠ,ŌŅņŹĒĢåĻµÓŠ×Ō·¢µŲĻņ»ģĀŅ¶ČŌö¼ÓµÄ·½Ļņ×Ŗ±äµÄĒćĻņ
NH3 (g)+H2O(g)+CO2(g)””¦¤H=+185.57 kJ”¤mol-1ÄÜ×Ō·¢½ųŠŠ,ŌŅņŹĒĢåĻµÓŠ×Ō·¢µŲĻņ»ģĀŅ¶ČŌö¼ÓµÄ·½Ļņ×Ŗ±äµÄĒćĻņ
C£®ŅņĪŖģŹ±äŗĶģŲ±ä¶¼Óė·“Ó¦µÄ×Ō·¢ŠŌÓŠ¹Ų,Ņņ“ĖģŹ±ä»ņģŲ±ä¾łæÉŅŌµ„¶Ą×÷ĪŖ·“Ó¦×Ō·¢ŠŌµÄÅŠ¾Ż
D£®ŌŚĘäĖūĶā½ēĢõ¼ž²»±äµÄĒéæöĻĀ,Ź¹ÓĆ“ß»Æ¼Į,æÉŅŌøıä»Æѧ·“Ó¦½ųŠŠµÄĖŁĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļ¹óÖŻŹ”×ńŅåŹŠø߶žÉĻѧʌʌ֊»Æѧ£ØĪÄ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĻÖĻóÓėµē»ÆѧøÆŹ“ĪŽ¹ŲµÄŹĒ
A£®»ĘĶ£ØĶŠæŗĻ½š£©ÖĘ×÷µÄĶĀą²»ŅײśÉśĶĀĢ
B£®ÉśĢś±ČČķĢśŠÄ£Ø¼øŗõŹĒ“æĢś£©ČŻŅ×ÉśŠā
C£®ĢśÖĘĘ÷¼žø½ÓŠĶÖŹÅ伞£¬ŌŚ½Ó“„“¦Ņ×ÉśŠā
D£®ŅųÖŹ½±ÅĘŌŚæÕĘųÖŠ¾ĆÖĆŗó±ķĆę±ä°µ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014Ēļø£½ØŹ”ø߶žÉĻѧʌʌ֊»Æѧ£ØĪÄ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŌĻĀŹµŃé²Ł×÷ÕżČ·µÄŹĒ
A£®ÓĆĮæĶ²ĮæČ”5.0 mLÅØĮņĖį²¢Ö±½ÓŌŚĮæĶ²ÖŠĻ”ŹĶ
B£®ÓĆ×ģ“µĆšČ¼×ÅµÄ¾Ę¾«µĘ»šŃę
C£®³ĘĮæNaOH¹ĢĢåŹ±£¬½«Ņ©Ę·Ö±½Ó·ÅŌŚĶŠÅĢÉĻ
D£®øųÉÕĘæĄļµÄŅŗĢå¼ÓČČŹ±£¬µęÉĻŹÆĆŽĶų
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com