
| A. | 用A表示的反应速率是0.4mol•(L•min)-1 | |
| B. | 在2min末的反应速率,用B表示是0.3mol•(L•min)-1 | |
| C. | 分别用B、C、D表示反应的速率,其比是3:2:1 | |
| D. | 在这2min内用B和C表示的反应速率的值都是逐渐减小的 |
分析 经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,结合反应速率之比等于化学计量数之比来解答.
解答 解:经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,
A.A物质为纯固体,不能表示反应速率,故A错误;
B.反应速率为平均速率,则在2min内的反应速率,用B表示是0.3 mol•(L•min)-1,故B错误;
C.反应速率之比等于化学计量数之比,则分别用B、C、D表示的反应速率其比值是3:2:1,故C正确;
D.B为反应物,C为生成物,则在这2min内用B和C表示的反应速率的值都是逐渐减小,故D正确;
故选CD.
点评 本题考查化学反应速率的计算及与化学计量数的关系,明确计算公式及反应速率为平均速率即可解答,注意选项A为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
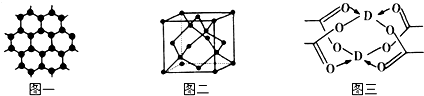
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入稀硝酸,无沉淀产生,然后再加硝酸钡溶液,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,无产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑥ | C. | ②④⑥ | D. | ①②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够提高化学反应速率 | B. | 能够提高产品的产量 | ||
| C. | 能够提高经济效益 | D. | 能够节约原料和能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,由两种元素组成的三原子共价化合物的电子式
,由两种元素组成的三原子共价化合物的电子式 或
或 .(各写1种)
.(各写1种)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |

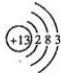
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,N2和H2反应生成NH3 | D. | 豆科植物根瘤菌把N2变成NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com