
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
分子、原子和离子都是构成物质的粒子。请按要求用符号完成下面问题(每题答案不唯一,请务必写全)
(1)五氧化二磷分子中的原子 ; (2)氯化镁中溶液中的离子 ;
(3)化肥硫酸铵中的原子团离子 ;(4)空气中的分子 (至少写两种);
查看答案和解析>>
科目:高中化学 来源: 题型:
在测定中和热的实验中,下列说法正确的是
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C. 用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D. 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
加热N2O5,依次发生的分解反应为①N2O5(g)  N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)  N2O(g)+O2(g)。在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol,则t ℃时反应①的平衡常数为( )
N2O(g)+O2(g)。在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol,则t ℃时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学的目标是 ( )
A.减少对环境的污染 B.防患于未然,最终杜绝化学污染源
C.设计对人类健康和环境更安全的化合物
D.研究变换基本原料和起始化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物
⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
A.①②⑥ B.②③⑥ C.①②⑥⑦ D.①②③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化
H2O2 → H2O IO3- →I MnO4- → Mn2+ HNO3 → NO
如果用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B. IO3- C. MnO4- D.HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g ,后者增重22g(假定气体全部吸收)。试通过计算推断该烃的分子式(要有计算过程)。若该烃的一氯代物只有一种,试写出该烃的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
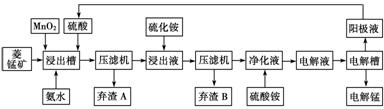
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com