
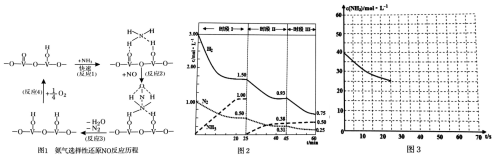
分析 (1)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式;
(2)①根据v=$\frac{△c}{△t}$计算出前20min内氨气的平均反应速率v(NH3),根据达到平衡时生成氨气的物质的量及热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1计算出放出的热量;
②根据25min时氨气的物质的量变为0,而氮气和氢气的物质的量不变进行解答,改变的条件是分离出氨气;
③根据时段Ⅲ条件下达到平衡时各组分的浓度及平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积进行解答;
(3)催化剂改变反应速率不改变化学平衡,依据催化剂的作用画出图象.
解答 解:(1)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O,
故答案为:4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O;
(2)①根据图象可知,20min时氨气的物质的量浓度为1.00mol/L,所以氨气的平均反应速率为:v(NH3)=$\frac{1.00mol/L}{20min}$=0.050mol(L•min)-1;
达到平衡时生成的氨气的物质的量为:1.00 mol/L×1L=1.00mol,
根据N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1可知生成2.00mol氨气放出的热量为94.4kJ,
故答案为:0.050mol(L•min)-1; 94.4kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时改变的条件是将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
③时段Ⅲ条件下,反应为:N2(g)+3H2(g)?2NH3(g),图象方向可知平衡状态下[N2]=0.25mol/L,[NH3]=0.50mol/L,[H2]=0.75mol/L,该反应的化学平衡常数为:K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})c({N}_{2})}$=$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$,
故答案为:$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$;
(3)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g),反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度20mol/L×50%=10mol/L;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 40 20 0 0
变化量(mol/L) 20 10 0 10
平衡量(mol/L) 20 10 0 10
若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示: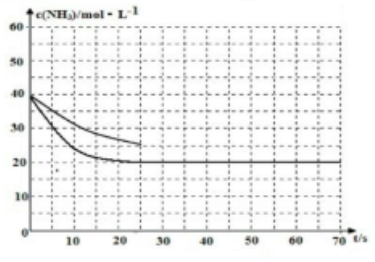 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及化学平衡影响因素分析、化学平衡的计算等知识,题目难度中等,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 试剂(必要时可加热 | 物质 |
| A | 硝酸银溶液 | 氯化钠溶液和碳酸钠溶液 |
| B | 氯气 | 硫酸亚铁溶液和FeCl2溶液 |
| C | MnO2 | 浓盐酸和稀硫酸 |
| D | 紫色石蕊试剂 | 次氯酸钙和次氯酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
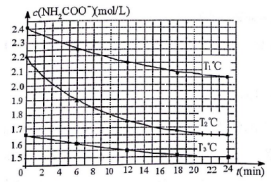 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比为1:1 | B. | 密度之比为4:11 | ||
| C. | 体积之比为4:11 | D. | 原子数之比为5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯和乙酸均能发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,它可使酸性 KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图)最多能与含5mol NaOH的水溶液完全反应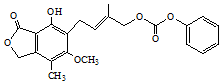 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(HCl)<n(NH3•H2O) | B. | 盐酸过量 | C. | 恰好中和 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中水银“积变又还成丹砂”说明水银发生了还原反应 | |
| B. | ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu | |
| C. | 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒 | |
| D. | 水银能跟曾青发生置换反应生成单质铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com