
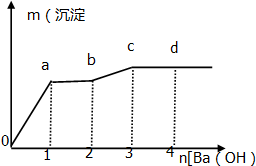
| A. | O→a时的反应的离子方程式为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2 H2O | |
| B. | a→b时发生的离子反应为H++OH-═H2O | |
| C. | 原混合溶液中 C(HCl):C(MgSO4)=3:1 | |
| D. | 从a→b→c说明溶液中结合OH-的能力强弱为:H+>Mg2+ |
分析 向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,开始阶段发生的反应为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,对应图象为o-a段;图象a-b段中沉淀不变,消耗了1mol氢氧化钡,说明发生反应:H++OH-=H2O,则此时消耗氢离子为2mol;
b-c段加入1mol氢氧化钡,沉淀物质的量增加,发生反应为:Mg2++2OH-=Mg(OH)2↓,说明原溶液中含有镁离子1mol;
c-d段沉淀的量不变,说明此时镁离子完全沉淀,据此进行解答.
解答 解:向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,开始阶段发生的反应为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,对应图象为o-a段;图象a-b段中沉淀不变,消耗了1mol氢氧化钡,说明发生反应:H++OH-=H2O,则此时消耗氢离子为2mol;
b-c段加入1mol氢氧化钡,沉淀物质的量增加,发生反应为:Mg2++2OH-=Mg(OH)2↓,说明原溶液中含有镁离子1mol;
c-d段沉淀的量不变,说明此时镁离子完全沉淀,
A.根据分析可知,O→a时的反应的离子方程式为Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故A正确;
B.a-b段中沉淀不变,消耗了1mol氢氧化钡,说明发生反应为:H++OH-=H2O,故B正确;
C.根据分析可知,O→a时的反应的离子方程式为Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,消耗了1mol氢氧化钡,a-b段中沉淀不变,消耗了1mol氢氧化钡,说明发生反应:H++OH-=H2O,b-c段加入1mol氢氧化钡,沉淀物质的量增加,发生反应为:Mg2++2OH-=Mg(OH)2↓,所以c(HCl):c(MgSO4)=(1+1)×2:1=4:1,故C错误;
D.根据分析可知,a-b段中沉淀不变,消耗了1mol氢氧化钡,说明发生反应:H++OH-=H2O,b-c段加入1mol氢氧化钡,沉淀物质的量增加,发生反应为:Mg2++2OH-=Mg(OH)2↓,所以溶液中结合OH-的能力强弱为:H+>Mg2+,故D正确;
故选C.
点评 本题考查了混合物反应的计算,侧重考查离子反应的计算,题目难度中等,明确发生反应的先后顺序为解答关键,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 等浓度的碳酸钠溶液和硫酸钠溶液,前者碱性强,可以证明硫的非金属性比碳强 | |
| D. | 验证氧化性Fe3+<Br2<Cl2:向试管中依次加入1mL 0.1mol•L-1FBr2溶液、几滴KSCN 溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机相和水相中的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
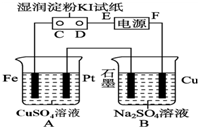 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时,因不慎使液面高于容量的刻度线,需重新配制 | |
| B. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后进行实验 | |
| C. | 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 | |
| D. | 取少量晶体放入试管中,加入适量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  如图中:MnO2过量,盐酸能全部消耗 | B. |  如图中:湿润的有色布条能褪色 | ||
| C. |  如图中:生成棕色的烟 | D. |  如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com