
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1, I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1, I4=10 540 kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式_________。
(2)比较BA2-和BA3的键角∠ABA的大小:BA2-____(填“>”“=”或“<”)BA3,请用价层电子对互斥理论解释:____________。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() 该同学所画的电子排布图违背了_______。
该同学所画的电子排布图违背了_______。
(4)E位于_____族_____区,价电子排布式为______。
(5)检验D元素的方法是______,请用原子结构的知识解释产生此现象的原因是______
【答案】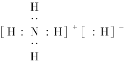 < NH2-中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小 泡利不相容原理 第ⅦB d 3d54s2 焰色反应 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量
< NH2-中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小 泡利不相容原理 第ⅦB d 3d54s2 焰色反应 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量
【解析】
A、B、C、D、E为短周期主族元素,它们的原子序数依次增大;A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,为H元素;B元素原子的核外p电子数比s电子数少1,且B是短周期元素,如果B是第三周期元素,则不可能出现p电子比s电子少1,则B为第二周期元素,B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D是前四周期中电负性最小的元素,则D是K元素;E在周期表的第七列,则E是Mn元素。
(1)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数越多,排斥作用越强,键角越小,NH2-中N原子孤电子对数为2,NH3中N原子孤电子对数为1,则NH2-键角小于NH3,故答案为:NH2-中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小;
(3)由电子排布图可知,3s能级中2个电子自旋方向相同,违背了泡利原理,故答案为:泡利原理;
(4)E为Mn元素,原子序数为25,位于元素周期表第四周期ⅦB族,电子排布式为[Ar]3d54s2,有电子排布式可知Mn元素位于为d区价电子排布式为3d54s2,故答案为:ⅦB;d;3d54s2;
(5)D为K元素,检验K元素的方法是焰色反应,产生此现象的原因是当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量,故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量。


科目:高中化学 来源: 题型:
【题目】瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。
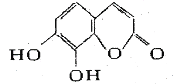
(1)瑞香素的化学式为______,含氧官能团名称______;
(2)1mol此化合物可与___molBr2反应,在一定条件下与H2反应时,最多消耗H2的物质的量为__mol,最多可以与____molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表___(填元素符号);其中电负性最大的是___(填图中的序号)。
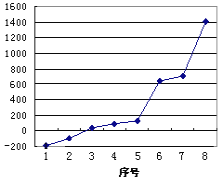
(2)请写出比元素1的原子序数大8的元素的基态原子电子排布式___。
(3)元素7的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
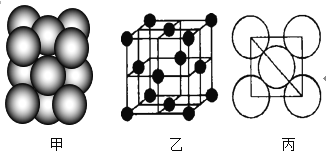
若已知7的原子半径为d cm,NA代表阿伏加德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为___,一个晶胞中7原子的数目为___;
②该晶体的密度为___ g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:

完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某橙色含结晶水的盐X的组成和性质,设计并完成如图实验。请回答:

(1)X的化学式是___。
(2)乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是__(填写相应的字母)。
A.Mg B.CaCl2 C.NaOH D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2
C. 已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
D. 已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①![]() Li ②石墨 ③C60 ④
Li ②石墨 ③C60 ④![]() Mg ⑤ CH3CH2OH ⑥
Mg ⑤ CH3CH2OH ⑥![]() C ⑦
C ⑦![]() Li ⑧ CH3OCH3 中:____互为同位素; ____互为同分异构体;___互为同素异形体(填序号)
Li ⑧ CH3OCH3 中:____互为同位素; ____互为同分异构体;___互为同素异形体(填序号)
(2)现有①CaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤冰 等五种物质,按下列要求回答:
①熔化时不需要破坏化学键的是___________,熔点最高的是_______。(填序号)
②只含有离子键的物质是______,晶体以分子间作用力结合的是______。(填序号)
(3)写出下列物质的电子式
①H2O______
②NaOH______
③NH3______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和1H核磁共振谱如下图所示,下列说法中错误的是( )
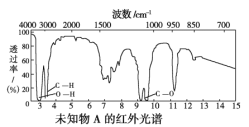
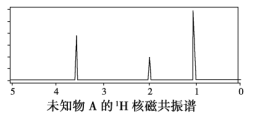
A. 由红外光谱图可知,该有机物中至少含有三种不同的化学键
B. 由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
D. 仅由其1H核磁共振谱就可得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节题组:有机合成路线设计
(1)用丙醛(CH3—CH2—CHO)制取聚丙烯的过程中发生的反应类型为________
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原
A.⑥②③ B.⑤②③ C.②④⑤ D.①④⑥
(2)以CH2==CHCH2OH为主要原料(无机试剂任用)设计CH2==CHCOOH的合成路线流程图(已知CH2=CH2可被氧气催化氧化为 ![]() )_________________
)_________________
学法题:通过此题的解答,总结设计有机合成路线需注意(至少写2条)___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com