
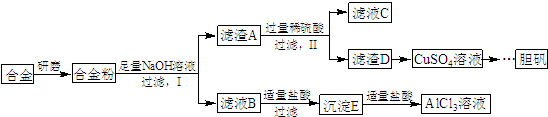
 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.分析 合金中铝具有两性,能与氢氧化钠反应,故滤渣A是金属Fe和金属Cu,滤液中含有偏铝酸根离子,滤渣A中加入稀硫酸F溶解,Cu不溶解,故滤渣D使金属Cu,滤液C中含有亚铁离子,滤液B中加入适量HCl生成氢氧化铝沉淀,再加入适量盐酸变为氯化铝溶液;
(1)研磨成粉末可以增大反应物的接触面积,从化学反应速率方面考虑即可;
(2)铝、铁和铜三种金属中,只有金属铝能与氢氧化钠溶液反应,过滤后铁与稀硫酸反应生成硫酸亚铁和氢气,依据氧化还原反应原理书写方程式即可;
(3)氢氧化铝具有两性,即溶于强酸也溶于强碱,但是不溶于弱酸,据此解答即可;
(4)根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式.
解答 解:(1)把合金研磨成合金粉,即把块状固体研磨成细小的颗粒,增大了反应物的接触面积,加快了化学反应速率,
故答案为:增大反应物的接触面积,使反应速率加快;
(2)三种金属只有金属铝是两性金属,与氢氧化钠的溶液反应,反应生成氢气、偏铝酸钠,化学反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
过滤后铁与稀硫酸反应生成硫酸亚铁和氢气,反应方程式为:Fe+H2SO4=FeSO4+H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Fe+H2SO4=FeSO4+H2↑;
(3)偏铝酸钠溶于过量的HCl会直接生成氯化铝而得不到氢氧化铝沉淀,氢氧化铝不溶于弱酸,故利用碳酸的弱酸性代替HCl,此气体为二氧化碳,电子式为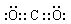 ,偏铝酸钠中通入过量的二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠,离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
,偏铝酸钠中通入过量的二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠,离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为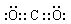 ;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O,改成离子反应方程式为:Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O.
点评 本题考查制备方案的设计,题目难度中等,涉及化学反应速率影响、化学方程式、离子方程式书写等知识,根据制备流程明确实验原理为解答关键,试题有利于提高学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子层数越多的微粒半径一定较大 | |
| B. | 由5R-+RO-+6H+=3R+3H2O 判断,R元素可能是第ⅤA族元素 | |
| C. | 元素周期表对于生产和科研具有重要的指导意义,如半导体材料通常位于过渡元素区 | |
| D. | 既有非金属元素简单阴离子,又有非金属元素简单阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | |
| D. | 金属性:K>Ca>Mg>Be |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最常见的氢化物的沸点:Y>X>W>Z | |
| B. | 简单离子半径:W>X>Y>Z | |
| C. | Y与Z能形成化学键类型完全相同的两种化合物 | |
| D. | Z与W形成的常见化合物溶于水后,水的电离程度变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| B. | 制作航天服的聚脂纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 重金属离子能杀死H7N9禽流感病毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44 g由CO2和N20组成的混合气体中的氧原子数为2NA | |
| B. | 1 mol由异丁烷和正丁烷组成的混合物中含有的共价键数目为13NA | |
| C. | 2 mol SO2与2 molO2充分反应生成的SO2分子数为NA | |
| D. | 100 mL 12 mol•L-1浓盐酸与足量MnO2反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3++S2-=Fe2++S | B. | Fe3++Fe=2Fe2+ | ||
| C. | Fe2++Cl2=Fe3++2Cl- | D. | 2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com