
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是
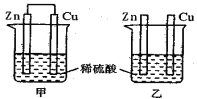
A. 甲中铜片是正极,乙中铜片是负极
B. 甲中铜被氧化,乙中锌被氧化
C. 产生气泡的速率甲比乙快
D. 两烧杯中铜片表面均无气泡产生
【答案】C
【解析】分析:甲为原电池,Zn比Cu活泼,Zn为负极,Zn被氧化,Cu为正极,Cu片表面产生气泡;乙不组成原电池,Zn与稀硫酸发生置换反应产生H2,Cu与稀硫酸不反应;形成原电池加快产生H2的速率。
详解:A项,甲为原电池,Zn比Cu活泼,Zn片为负极,Cu片为正极,乙不组成原电池,A项错误;B项,甲中Zn为负极,负极电极反应式为Zn-2e-=Zn2+,Cu为正极,Cu电极上的电极反应式为2H++2e-=H2↑,乙中Zn失电子,被氧化,反应的离子方程式为Zn+2H+=Zn2++H2↑,甲、乙中都是Zn被氧化,B项错误;C项,甲为原电池,乙不组成原电池,甲、乙中总反应都为Zn+2H+=Zn2++H2↑,产生气泡的速率甲比乙快,C项正确;D项,甲中Cu电极上的电极反应式为2H++2e-=H2↑,甲烧杯中Cu片表面有气泡产生,D项错误;答案选C。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 根据右图对照试验实验1、2的现象可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol L-1 的盐酸和硫酸反应,后者更剧烈
B. 右图实验2中生成红色物质的离子方程式:Al+Cu2+=Al3++Cu
C. 探究FeCl3和KI溶液反应限度:将1mL0.1mol L-1 FeCl3溶液加入到5 mL 0.1mol L-1KI溶液中,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察现象
D. 水电离出的c(H+)=10-10 mol L-1的溶液:Na+、K+、Cl-、HCO3-可以共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 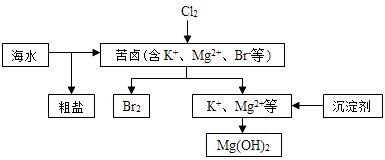
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置就用于实验室制取NH3 , 并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
A.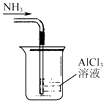
吸收NH3制取Al(OH)3
B.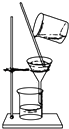
在不断搅拌下分离Al(OH)3和NH4Cl溶液
C.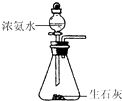
制取NH3
D.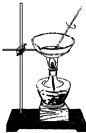
蒸干NH4Cl溶液并灼烧制NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-![]() H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是
A. 在Na2B溶液中一定有:c(OH![]() )=c(H
)=c(H![]() )+c(HB
)+c(HB![]() )+2c(H2B)
)+2c(H2B)
B. NaHB溶液可能存在以下关系:c(Na![]() )>c(HB
)>c(HB![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() )
)
C. NaHB水溶液中一定有:c(Na![]() )+c(H
)+c(H![]() )=c(HB
)=c(HB![]() )+c(OH
)+c(OH![]() )+c(B
)+c(B![]() )
)
D. NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的密度依次增大
B.单质的熔、沸点依次升高
C.Cl2可以从KI溶液中置换出I2
D.Br2可以从NaCl溶液中置换出Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组探究利用废铜屑制取CuSO4溶液,设计了以下几种实验方案:
(1)方案一:以铜和浓硫酸反应制备硫酸铜溶液.方案二:将废铜屑在空气中灼烧后再投入稀硫酸.和方案一相比,方案二的优点是;
(2)方案二的实验中,发现容器底部残留少量紫红色固体,再加入稀硫酸依然不溶解,该固体为 .
(3)方案三的实验流程如图1所示:溶解过程中有气体放出,该气体是 . 随着反应的进行,生成气体速度加快,推测可能的原因 . 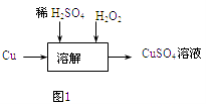
(4)设计实验证明你的推测 .
(5)方案四的实验流程如图2所示:为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为 . 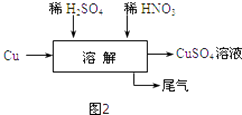
(6)对方案四进行补充完善,设计一个既能防止污染,又能实现物料循环的实验方案(用流程图表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com