
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |


分析 (1)根据仪器A的特征以及常见仪器的名称解答;仪器B为球形冷凝管,仪器C为直行冷凝管,球形冷凝管冷凝效果要优于直形冷凝管,球形冷凝管接触面积大;
(2)有活塞或塞子的仪器使用前应检查是否漏水,分液漏斗内的液体不能过多,能用分液漏斗分离的混合物应互不相溶,可用分液的方法分离;充分振荡后,在旋开旋塞之前,应使分液漏斗内外压强相等,分液漏斗中先放下层液体后放上层液体,避免上下层液体交叉;
(3)上层为苯甲醇的粗品,操作③是用沸水浴加热蒸馏,操作④的目的是得到苯甲醇的馏分,苯甲醇沸点205℃,图2温度计的水银球位置错误;
(4)将烧杯中的苯甲酸晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用滤液冲洗杯壁上残留的晶体,减少晶体的损失;抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头;
(5)苯甲酸和NaOH溶液发生酸碱中和反应,根据苯甲酸和NaOH之间的关系式计算苯甲酸的质量,从而计算苯甲酸的质量分数.
解答 解:(1)根据装置图可知仪器A具有三颈特征,名称为三颈烧瓶(或三口烧瓶),仪器B为球形冷凝管,仪器C为直行冷凝管,B的接触面积大,冷却回流苯甲醛的效果好,所以若将仪器B改为仪器C,效果不如B,
故答案为:三颈烧瓶(或三口烧瓶);B的接触面积大,冷却回流苯甲醛的效果好;
(2)A.分液漏斗中有玻璃活塞,在使用之前需检验是否漏水,故A正确;
B.分液漏斗内的液体不能过多,否则不利于震荡,故B正确;
C.在旋开旋塞之前,应该使分液漏斗顶部活塞上的凹槽或小孔对准漏斗的上口颈部的小孔,使与大气相通,故C错误;
D.分液时待下层的液体放完后立即关闭旋塞,换掉烧杯,从分液漏斗上口将上层液体倒出,故D错误;
故答案为:CD;
(3)操作④的目的是得到苯甲醇的馏分,所以收集205℃的馏分,蒸馏时,温度计测量的是苯甲醇蒸气的温度,所以温度计的水银球应处于蒸馏烧瓶的支管口处,
故答案为:205;温度计的水银球处于蒸馏烧瓶的支管口;
(4)将烧杯中的苯甲酸晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将烧杯壁上的晶体冲下来后转入布氏漏斗,目的减少晶体的损失,所以选择冲洗的液体应该是不会使晶体溶解损失,也不会带入杂质的,选择用滤液来冲洗是最好的,洗涤时为洗净晶体,应让洗涤剂缓慢通过滤纸,让洗涤剂和晶体充分接触,抽滤完成后用少量冰水对晶体进行洗涤,洗涤应关小水龙头,
故答案为:滤液;关小水龙头;
(5)根据化学反应C6H5COOH+NaOH→C6H5COONa+H2O,反应消耗0.1000mol/LNaOH溶液19.20mL,物质的量为0.1000mol/L×0.0192L=0.00192mol,则苯甲酸中苯甲酸的质量=0.0192mol/L×122g/mol=2.3424g,其质量分数=$\frac{2.3424g}{2.440g}$=96.00%,
故答案为:96.00%.
点评 本题考查有机物苯甲醇、苯甲酸的制备,侧重考查反应流程理解、装置的用途等,是对学生综合能力的考查,需要学生具备扎实的基础,关键在于能够掌握实验操作的原理和注意事项,注意相关实验操作知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | NaOH溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H 1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(s)+O2(g)=SO2(g)△H 1; S(g)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H 1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H 1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol | B. | 2SO2(g)+O2(g)=SO3(g)△H=-196.6kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-517.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ/mol | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol | |
| C. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ/mol | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
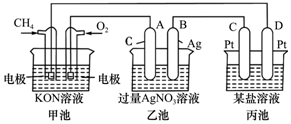 根据下列电化学装置,回答下列问题:
根据下列电化学装置,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com