
ij��ȤС��ͬѧ��ʵ�����ü���l��������ŨH2SO4���廯�ƻ����ķ������Ʊ�1���嶡�飬���������ͼ��ʾ��ʵ��װ�ã����еļг�����û�л�������
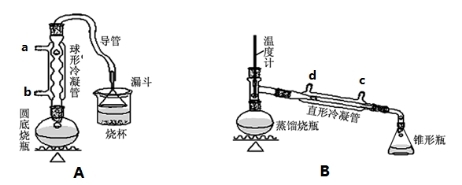
��ش��������⣺
��1��Aװ���У����ձ����Һ�浹��һ��©������Ŀ���� ������װ���ж��õ��������ܣ�Aװ������ˮ�� ������ĸ���ţ����룬Bװ������ˮ�� ������ĸ���ţ����롣
��2���Ʊ������У������Ũ�������ȱ������ϡ�ͣ���Ŀ���� ��������ĸ��
a�����ٸ�����ϩ���ѵ����� b������Br2������ c��ˮ�Ƿ�Ӧ�Ĵ���
��3����ͬѧ��ͨ����������Ǽ������ò������Ƿ��С���CH2CH2CH2CH3������ȷ�����������Ƿ���ڶ��ѣ�CH3CH2CH2CH2OCH2CH2CH2CH3���������۸�ͬѧ��Ƶļ��������Ƿ������Ϊʲô���� ��
��4��Ϊ�˽�һ���ᴿ1���嶡�飬��С��ͬѧ�������л�����й��������±���
���� | �۵㣯�� | �е㣯�� |
1������ | ��89.5 | 117.3 |
1���嶡�� | ��112.4 | 101.6 |
���� | ��95.3 | 142.4 |
1����ϩ | ��185.3 | ��6.5 |
����Bװ����ɴ��ᴿʵ��ʱ��ʵ����ҪѸ�������¶��� �ռ�������֡�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ��ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
��һ���¶��£����Ϊ2L���ܱ������У�NO2��N2O4֮�䷢����Ӧ��2NO2(g)(����ɫ) N2O4g)(��ɫ)����ͼ��ʾ��
N2O4g)(��ɫ)����ͼ��ʾ��
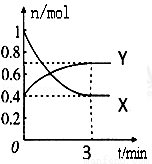
��1������ (�X����Y��)��ʾNO2�����ʵ�����ʱ��ı仯���ߣ�
��2���������¶ȣ���v(��) ��v(��) ��(��ӿ족���������䡱)��
��3����������Ӧ�ڼס���������ͬ������ͬʱ���У��ֱ��ü���v(NO2)=0.3mol/(L•s)������v(N2O4)=6mol/(L•min)���� �з�Ӧ���죮
��4����0��3min����N2O4�ķ�Ӧ����Ϊ ��
��5������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����(����) ��
A��v(NO2)=2v(N2O4)
B��������ѹǿ���ٷ����仯
C��X������������ٷ����仯
D������������ԭ���������ٷ����仯
E����ͬʱ��������n mol��Y��ͬʱ����2n mol��X
F����ͬʱ��������n mol��Y��ͬʱ����2n mol��X��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ�߶�6���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ֱ�ʢ��100 mLˮ��100 mL 0.1 mol��L��1���ᡢ100 mL 0.01 mol��L��1����ͭ��Һ��X��Y��Z�����ձ��и�Ͷ��0.05 mol Na�������й�˵����ȷ���ǣ� ��
A�������ձ��о��ᷢ�������ӷ�ӦΪ2Na��2H2O=2Na����2OH����H2��
B�������ձ����ƾ���Һ���Ͼ��ҷ�Ӧ����X�ձ��з�Ӧ�����
C�������ձ���Ӧ�����ɵ����ʵ����ʵ���Ũ����ͬ
D�������ձ���Ӧ�����ɵ����������һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��������У�߶��µ��Ĵ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯��������������±���
ʵ���� | ��ʼŨ��/��mol��L��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c��KOH�� | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
�����жϲ���ȷ����
A��ʵ��ٷ�Ӧ�����Һ�У�c��K������c��A������c��OH������c��H����
B��ʵ��ٷ�Ӧ�����Һ�У�c��OH����=c��K������c��A����=  mol��L��1
mol��L��1
C��ʵ��ڷ�Ӧ�����Һ�У�c��A������c��HA����0.1mol��L��1
D��ʵ��ڷ�Ӧ�����Һ�У�c��K����=c��A������c��OH���� =c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��������У�߶��µ��Ĵ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ����ȷ����
A��������������Һ�еμ�Ba��OH��2��Һǡ�������ԣ�2H+��SO42����Ba2+��2OH����BaSO4����2H2O
B�������ʵ���Ũ�ȵ�FeI2��Һ����ˮ�������ϣ�2Fe2+��2I����2Br2��2Fe3+��I2��4Br��
C���ö��Ե缫���CuSO4��Һ��2Cu2����2H2O 2Cu��O2����4H��
2Cu��O2����4H��
D�����⻯��ˮ�⣺HS����H2O H2S��OH��
H2S��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡʯ��ׯ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij���ķ���ʽΪC6H12O2����仯��ͼ��ʾ����A�ܷ���������Ӧ��C���ܷ���������Ӧ��������Ŀ��ܽṹ��

A��3�� B��4�� C��5�� D�� 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡʯ��ׯ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���л���Ľṹ��ʽ����ͼ�������������ʲ���ȷ��˵����

A���������ԣ�1mol�������������6molH2�����ӳɷ�Ӧ
B����һ�������£�1mol����������ܺ�4molBr2 ��Ӧ
C��������ˮ�⣬ˮ�����Ϊ�����л���
D�����л����ܷ���ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
�л���A��һԪ���ᣬ��C��H��OԪ����ɣ�����������C%40%��H 6.67%��ȡ0.60 g A�����Һ���ú�0.01 mol NaOH ����Һ��ǡ����ȫ�к͡�
��1��A�����ʽΪ �����ʽ��Ϊ ��
��2��A����Է�������Ϊ ������ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�����и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���Խ���ӦZn��Br2 = ZnBr2��Ƴ����أ����б�ʾ�ŵ�ʱ�ĸ�����Ӧ���ǣ� ��
A��Zn �C 2e�� = Zn2�� B��Br2��2e�� = 2Br��
C��2Br����2e�� = Br2 D��Zn2����2e�� = Zn
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com