
| A. | NH4+,Ag+,NO3-,CO32-,SO42- | B. | Fe2+,H+,NO3-,Cl- | ||
| C. | Al3+、NH4+,HCO3-、Cl- | D. | K+、Na+、NO3-、SO42- |
分析 A.银离子与碳酸根离子、硫酸根离子反应;
B.硝酸根离子在酸性条件下能够氧化亚铁离子;
C.铝离子与碳酸氢根离子发生双水解反应;
D.四种离子之间不发生反应,在溶液中能够共存.
解答 解:A.Ag+与CO32-、SO42-之间反应生成沉淀,在溶液中不能大量共存,故A错误;
B.Fe2+、H+、NO3-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故C错误;
D.K+、Na+、NO3-、SO42-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| B. | 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
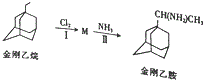 金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.
金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.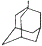 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
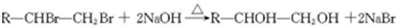 .
.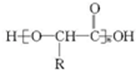 .
.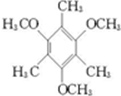 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
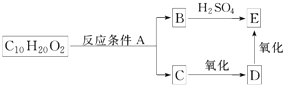
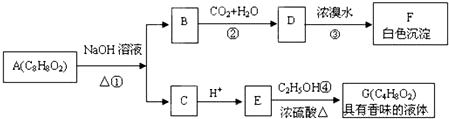
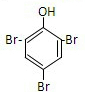 .
.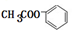 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$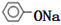 +CH3COONa+H2O.
+CH3COONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 在25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(NH4+)=c(SO42-) | |
| D. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
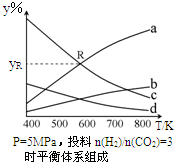 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA | |
| B. | 标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com