
【题目】下表为周期表的一部分,其中的编号代表对应不同的元素。

请回答下列问题。
(1)表中属于d区的元素是________(填编号);元素⑧的原子外围电子排布式是________。
(2)③和⑦形成的常见化合物的晶体类型是___ _____;②③④的电负性:________>________>________(用元素符号表示)。判断依据是__________________________,气态氢化物最稳定的是________(写化学式);
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的________(填编号);该元素与元素①形成的化合物X极易溶于水的原因是________________________________。
(4)②⑥形成化合物的化学式为________,其熔点比金刚石的________(填“高”或“低”)。
(5)⑤的氧化物与⑥的最高价氧化物的水化物反应的方程式为_____________________________。
【答案】(1)⑨ 3d104s1
(2)分子晶体 O N C 同周期元素从左到右的非金属性逐渐增强 H2O
(3)③ 氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键
(4)CS2低 (5)Al2O3+3H2SO4===Al2(SO4)3+3H2O
【解析】试题分析:根据元素周期表的结构,①到⑨号元素分别为H、C、N、O、Al、S、Cl、Cu、Fe。
(1)根据元素周期表的结构可知,表中属于d区的元素是⑨;元素⑧是29号元素铜,铜原子的外围电子排布式是3d104s1。
(2)③和⑦形成的常见化合物是NCl3,NCl3熔沸点较低,属于分子晶体;②③④分别为C、N、O,同周期元素,从左到右,元素的电负性逐渐增大,则它们的电负性:O>N>C,判断依据是同周期元素从左到右的非金属性逐渐增强,非金属性越强,气态氢化物越稳定,则气态氢化物最稳定的是H2O。
(3)因为s轨道只能填充2个电子,所以某元素的特征电子排布式为nsnnpn+1,该元素的价电子排布式为2s22p3,位于周期表的第2周期,第ⅤA族,即周期表中的③;N与元素H形成的化合物X为NH3,因为氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键,所以氨气极易溶于水。
(4)②⑥形成化合物是二硫化碳,二硫化碳的化学式为CS2,CS2属于分子晶体,金属石属于原子晶体,所以二硫化碳的熔点比金刚石的低。
(5)⑤的氧化物为Al2O3,⑥的最高价氧化物的水化物为H2SO4,氧化铝属于两性氧化物,能与硫酸反应生成硫酸铝和水,反应的方程式为Al2O3+3H2SO4===Al2(SO4)3+3H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | Fe腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届石家庄二模】[化学一选修5:有机化学基础]
聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
-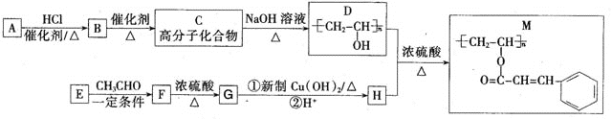

请回答:
(1)C的化学名称为_______________;M中含氧官能团的名称为_______________。
(2)F-G的反应类型为____ ;检验产物G中新生成官能团的实验方法为__________________
(3)C-D的化学反应方程式为 _______________。
(4)E的结构简式为_______________;H的顺式结构简式为_______________。
(5)同时满足下列条件的F的同分异构体有_______________种(不考虑立体异构);
①属于芳香族化合物 ②能发生水解反应和银镜反应。
其中核磁共振氢谱有4种吸收峰的物质的结构简式为 (任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com