
分析 在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂被还原,还原剂被氧化,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,以此解答.
解答 解:Fe+CuSO4=Cu+FeSO4中,铁元素的化合价由0价→+2价,铜元素的化合价由+2价→0价,所以铁是还原剂,硫酸铜是氧化剂,铜元素被还原,铁元素被氧化,硫酸亚铁是氧化产物,铜是还原产物,
故答案为:CuSO4;Fe;Fe;Cu;FeSO4;Cu;CuSO4;Fe.
点评 本题考查氧化还原反应,为高频考点,侧重于氧化还原反应的基本概念的考查,注意氧化剂、还原剂、还原产物和还原产物之间的区别,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 第IIIA的铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气 | |
| B. | 第VIIA的砹(At)为有色固体,易溶于四氯化碳,但难溶于水 | |
| C. | 第IIA的锶的硫酸盐(SrSO4)是易溶于水的白色固体 | |
| D. | 第VIA的硒的氢化物(H2Se)是无色、有毒,比H2S稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
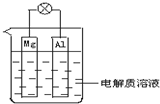 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
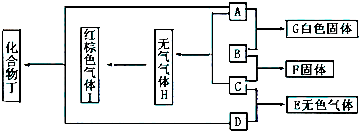
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、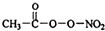 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
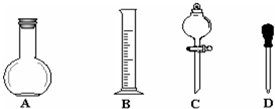 实验室需用1000mL 0.1mol•L-1标准Na2CO3溶液.请回答下列问题:
实验室需用1000mL 0.1mol•L-1标准Na2CO3溶液.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com