
下列叙述不正确的是
A.Li+中含有的中子数与电子数之比为2︰1
B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1
C.常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
D.5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A_________ E___________ L___________;
(2)在反应①②③④⑤中属于氧化还原反应的是_____________;
(3)反应③化学方程式为:______________________________;
(4)写出下列离子方程式:反应② ;G溶液与M溶液的反应___________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。

(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:计算题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
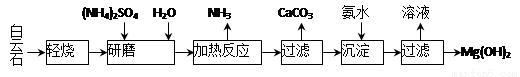
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
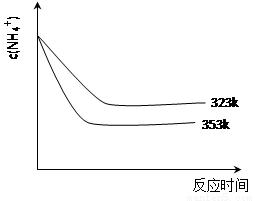
②由图可知,随着温度升高: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列说法或表达正确的是
A.氢氧化钠、氯化氢气体、氯化银都是电解质
B.AlCl3的熔点仅190 ℃而Al2O3的熔点为2050 ℃,因此熔融电解法冶炼铝使用AlCl3比Al2O3更好
C.向沸腾的NaOH溶液中滴加FeCl3饱和溶液, 可以制备Fe(OH)3胶体
D.足量氯气通入溴化亚铁溶液中:2Fe2++Cl2=2Cl-+2Fe3+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:简答题
碳和碳的化合物广泛的存 在于我们的生活中。
在于我们的生活中。
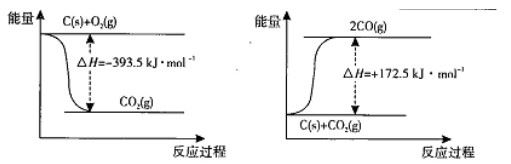
(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g) △H= 。

(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数( 25℃) | Ka1= Ka2= 5.61× 10一11 | Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知:NH4+水解的平衡常数Kh=Kw/Kb,
CO32-第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中CO32-
发生第一步水解的离子方程式 。
②下列粒子之间的关系式,其中正确的是 。
A.c(NH4+)>c(HCO3-)> c(CO32-)>(NH4+)
B.c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-)
C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L
D. c(NH4+)+ c(NH3.H2O)=2 c(CO32-)+ 2c(HCO3-) +2c(H2CO3)
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特
殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、 NO3-、Cl-
C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42-
D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:推断题
弹性涤纶是一种新型聚酯纤维,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
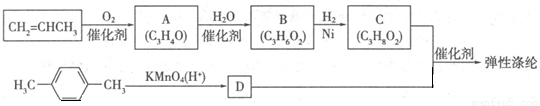
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,B中所含官能团的名称为 。
(2)由物质C与D反应生成弹性涤纶的化学方程式为 。
(3)由物质B到C的化学反应类型为 。
(4)写出C与足量钠反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com