
| A、4mol SO2+2mol O2 |
| B、1mol SO2+1mol O2 |
| C、1mol SO2+1mol O2+1mol SO3 |
| D、1mol SO2+0.5mol O2+1mol SO3 |


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
| A、与酸反应产生的氢气多 |
| B、与碱反应产生的氢气多 |
| C、一样多 |
| D、不知道铝粉的质量,无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取肥皂时,常常加入少量乙醇,目的是加快皂化反应 |
B、海水提镁的主要步骤为: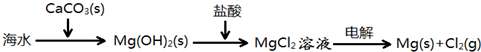 |
| C、工业上将二氧化碳和氨气通入食盐水中制的碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠 |
| D、用蒸馏法便可分离苯和溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
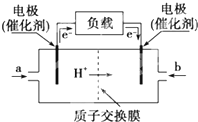 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )| A、右边的电极为电池的负极,b处通入的是空气 |
| B、左边的电极为电池的负极,a处通入的是甲醇 |
| C、电池负极的反应式为:2CH3OH+2H2O-12e-═2CO2↑+12H+ |
| D、电池正极的反应式为:3O2+12H++12e-═6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的铝分别与盐酸和氢氧化钠溶液反应生成氢气的物质的量 |
| B、1 mol/L KI与0.5 mol/L K2CO3溶液中的K+数目 |
| C、质量比为3:4的金刚石和石墨中的碳碳键数目 |
| D、常温下,pH均为3的HNO3与Fe(NO3)3溶液中,由水电离产生的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者都小于a% |
| B、两者都大于a% |
| C、两者都等于a% |
| D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com