
| A. | 饱和机物中碳原子不能发生化学反应 | |
| B. | C原子只能与C原子形成不饱和键 | |
| C. | 任何有机物中H原子数目不可能为奇数 | |
| D. | 五个C原子之间能够形成五个碳碳单键 |
分析 A.烷烃能发生取代反应;
B.碳原子与碳原子可以形成不饱和键,也可以形成饱和键;
C.卤代烃中含有H原子数可能为奇数;
D、碳原子可以形成碳链,也可以形成碳环,可以带支链,也可以不带支链.
解答 解:A.烷烃中的碳原子都是饱和碳原子,饱和碳原子能取代反应,故A错误;
B.碳原子与碳原子可以形成不饱和键,如烯烃,也可以形成饱和键,如烷烃,故B错误;
C.有的有机物分子中含有奇数个氢原子,如一氯甲烷、三氯甲烷等,故C错误;
D、碳原子可以形成碳链,无论带支链,还是不带支链,都含有4个C-C单键;碳原子可以形成碳环,可以带支链,也可以不带支链,都含有5个C-C单键,故D正确;
故选D.
点评 本题考查了有机物中碳的成键特点,题目难度不大,明确常见有机物组成、结构特点为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为Fe3+具有氧化性,所以可以用KSCN溶液检验Fe3+ | |
| B. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | FeCl2溶液蒸干灼烧后得到FeCl2固体 | |
| D. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径:X>Y,离子半径:X3+>Y2- | |
| C. | 同族元素中Y的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
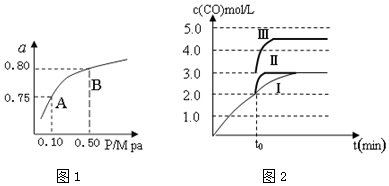
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
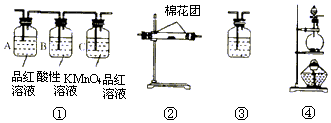 (1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系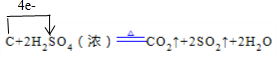 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体分解越完全,消耗盐酸的量越少 | |
| B. | 共生成0.1mol二氧化碳,固体中氯化钠为5.85g | |
| C. | 固体中碳酸氢钠含量越多,钠元素的含量也越多 | |
| D. | 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com